Country / Location Selection
|
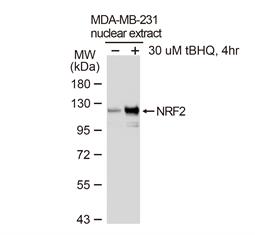
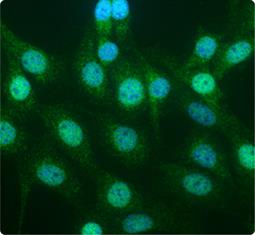
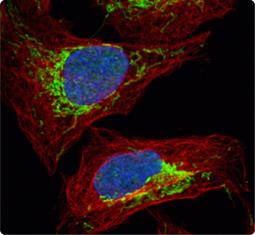
尽管活性氧(ROS)和活性氮(RNS)对于许多生理途径都是不可缺少的,但他们会损害细胞的基因组及其功能成分,ROS/RNS水平与细胞抗氧化剂防御之间的不平衡会导致氧化还原平衡的丧失和潜在的慢性病,这些防御中的主要参与者是bZIP转录因子NRF2(1)。在正常条件下,通过KEAP1/CUL3/RBX1-和GSK3β介导的机制,NRF2大部分保留在胞质中;而在氧化应激下,NRF2可以自由移动到细胞核,与DNA上的抗氧化剂反应组件(AREs)结合,并募集染色质修饰剂和转录共激活因子来驱动各种抗氧化应答和排毒效应因子的表达,因此,NRF2对于氧化压力下的生存至关重要,对其生物学的进一步研究可能揭示出多种严重人类疾病的新颖治疗方法。 |

|
NRF2包含605个氨基酸,可形成七个NRF2-ECH同源(NEH)域 (图一),每个域均指定用于特定功能。NEH包含bZIP结构,这对于NRF2与小肌腱膜纤维状(sMAF)蛋白和DNA结合的二聚化至关重要,除此作用外,NEH1还可以与Eb泛素结合酶UbcM2相互作用,负责调节NRF2蛋白的稳定性,它还包含一个对于NRF2的核转运至关重要的核定位信号(NLS),它在NRF2从其胞质抑制剂Kelch样ECH相关蛋白-1 (KEAP1)释放后被发现。NEH2域负责KEAP1介导的NRF2蛋白酶体降解,而NEH6域具有富含丝氨酸的区域,参与非依赖KEAP1的NRF2负调控。NEH3, NEH4和NEH5域负责在启动子中具有ARE序列基因的NRF2依赖性转录激活。NEH7结构域与作为NRF2阻遏物的视黄酸X受体a (RXR a)相互作用,545至554之间的肽具有核输出信号。 |
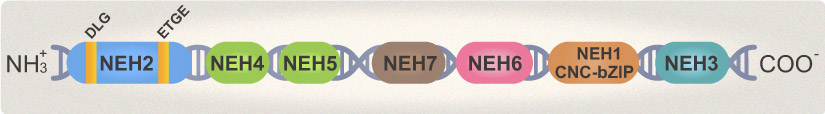 |
| (图一) |

|
NRF2的调节主要通过NRF2蛋白质水平的调控而发生,有三种E3泛素连接酶复合体负责NRF2的泛素化和降解,包括CUL3-RBX1-KEAP1复合物,SCF/β-TrCP复合物和HRD1,每种介质在特定的亚细胞区室中通过不同的刺激介导NRF2降解。CUL3-RBX1-KEAP1复合物响应细胞质中的亲电子/氧化应激;SCF/β-TrCP复合物可以是核的或胞质的,对代谢变化更为敏感,并受GSK3-β调控;HRD1定位于内质网(ER),仅被证明在内质网应激时使NRF2泛素化,重要的是其他信号通路,表观遗传因素和翻译后修饰(PTM)也调节NRF2。此外,可以通过靶向NRF2的负调控来实现NRF2途径的激活或抑制(图二)。 |
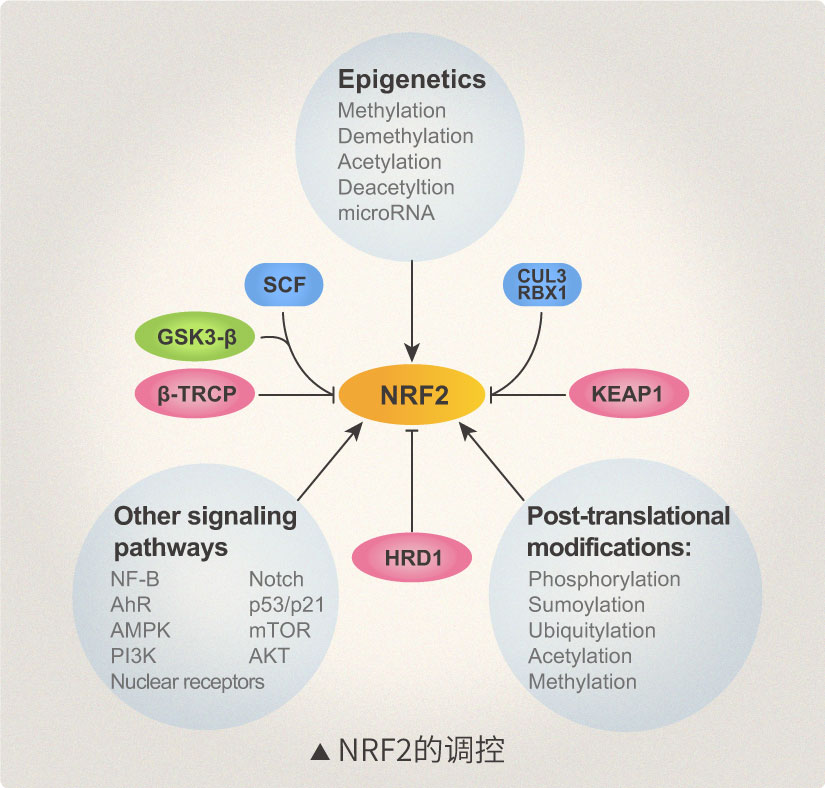 |
| (图二) |

|
NRF2是相对较新的研究,大多数的关键研究都发生在近40年间。目前发现已鉴定的250多种NRF2的目标基因参与了许多细胞过程,包括氧化还原调节、I-III期药物/异生物代谢、蛋白质稳态、DNA修复、预防细胞凋亡、碳水化合物和脂质代谢、铁稳态、自噬、蛋白质体组装、转录调控和线粒体功能(图三)。 |
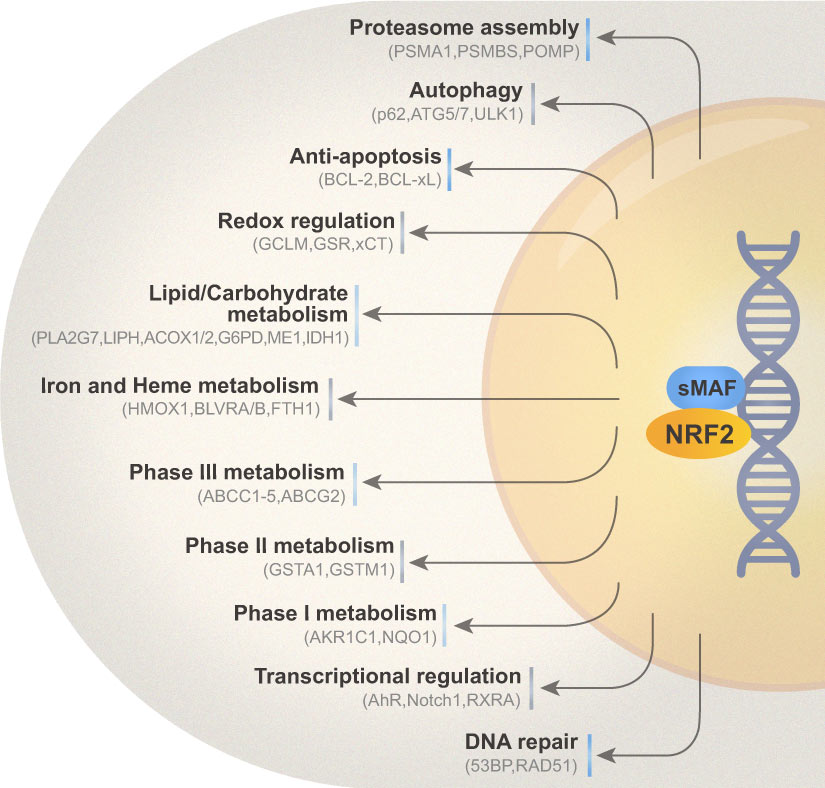 |
| (图三) |

|
在疾病中靶向NRF2的治疗可能性,取决于疾病的时间阶段和NRF2的表达水平,NRF2激活剂/抑制剂和当前的治疗选择基于癌症和其他慢性病中的NRF2水平。已经鉴定了几种NRF2抑制剂和激活剂,可以发展成翻译治疗剂,NRF2激活剂被认为在癌症开始或神经退行性或慢性癌症性疾病发作之前提供了最大的治疗益处,疾病发作后的治疗选择是针对NRF2进行干预并预防或延迟其进展。许多癌症类型均表现出高水平的NRF2,根据报道,一些疾病,例如糖尿病、心血管疾病、前列腺癌、炎性疾病和启动后/早期癌症的NRF2水平依时间不同,表达量可能较低或较高。对于高水平的NRF2具有有害作用的疾病,NRF2抑制剂或佐剂将是最有效的方法。NRF2含量高的癌症和晚期疾病通常与预后不良有关,现阶段的治疗主要是缓解症状并提高其他疗法的疗效,当前NRF2激活剂和抑制剂以及NRF2表现水平总结在(图四)中。 |
 |
| (图四) |
热门产品
![]()
![]()
![]()
![]()
![]()
|
|
|
|