Country / Location Selection
 |
人类武器从刀剑到弓箭再到枪炮,能在远距离就歼灭敌人再好不过。同样, 敌人的防御也从盾牌到飞弹防御系统,能提前防御就能减少大规模的伤害。而在体内,T细胞对癌细胞的PD1/PD-L1死亡之吻就像近身肉搏战, 而癌细胞也不是省油的灯, 发展出他自己的远程防御模式 - exosome,将PD-L1放在exosome, 可远程与免疫细胞的PD1结合,使免疫细胞失活。Exosome究竟是谁, 能像长程飞弹执行任务?
越来越多的文献描述了细胞外囊泡(包括外泌体)在肿瘤进展与抑制中的作用(1, 2)。所有真核细胞都会分泌一系列不同大小和内容物的囊泡,通常被称为细胞外囊泡(extracellular vesicles),细胞外囊泡是50纳米至2微米的囊泡,从许多不同类型的细胞表面释放到不同的体液中,包括血浆、乳汁、唾液、汗液、泪液、精液和尿液。
细胞外囊泡主要有三种形态, 外泌体(exosomes)、微泡(microvesicles)和凋亡小体(Apoptotic bodies)。外泌体(50-100纳米)是一种同质的细胞外囊泡群,当多囊泡内体(multivescular endosomes)在高度调节的过程中与质膜融合时,从细胞中释放出来,随后释出它们的内容物;而微泡是直径达2微米且更加异质的细胞外囊泡群,其通过细胞膜向外出芽和囊泡脱落形成,该过程涉及钙依赖性信号传导和酶活性;凋亡(Apoptosis)的细胞则释放直径为1-5微米的细胞外囊泡,被称为凋亡小体。其中外泌体携带许多细胞的重要信息,如脂筏(Lipid rafts)、蛋白质,以及一些遗传物质(核酸),也是近年来的热门研究主题(3, 4)。
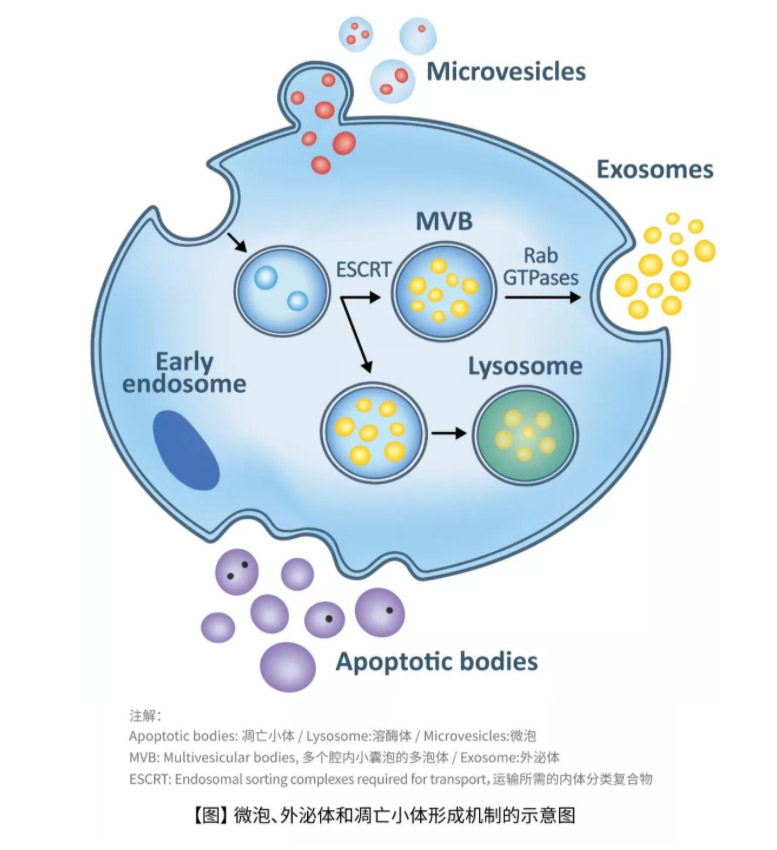
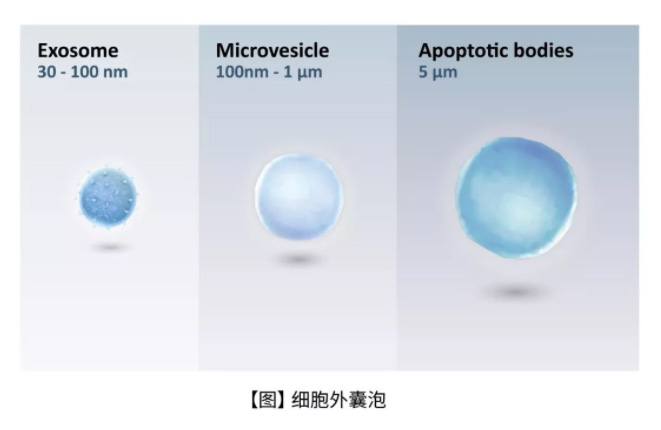
一般而言,外泌体的组成成分可根据其来源和细胞类型而不同,其中主要的蛋白包含
四跨膜蛋白:Tetraspanins: CD9, CD82, CD81和CD63,调节迁移(Migration)、侵袭(Invasion)、黏附(Adhesion)和融合受体细胞;
细胞内转运相关蛋白:Rab和Annexins,两者都可能促进多囊泡内体与细胞膜融合,和外泌体分泌的作用,其他参与细胞内转运和融合功能的蛋白质还有GTPase, flotillin和ADP ribosylation factors (ARFs) ;
细胞骨架蛋白:tubulin, actin, cofilin、酶和脂质也常见于外泌体腔中;
热休克蛋白: HSP70和HSP90,它们也可作为分子伴侣(Chaperones),帮助蛋白质在细胞内折迭和转运。
此外,某些T细胞MHC-I和II分子可存在于外泌体的表面上,参与特异性反应,而共刺激因子像CD86和黏附分子如CD54和CD11b也存在于表面,甚至热休克蛋白也加快抗原到 MHC分子。
除了上述蛋白外, 近年来越来越多的研究报导指出,外泌体也含有核酸,如DNA, miRNA和非编码RNA (5),可影响基因的表达,更凸显出外泌体的重要性。


此外,某些T细胞MHC-I和II分子可存在于外泌体的表面上,参与特异性反应,而共刺激因子像CD86和黏附分子如CD54和CD11b也存在于表面,甚至热休克蛋白也加快抗原到 MHC分子。
除了上述蛋白外, 近年来越来越多的研究报导指出,外泌体也含有核酸,如DNA, miRNA和非编码RNA (5),可影响基因的表达,更凸显出外泌体的重要性。
外泌体参与身体的许多生理和病理状况的功能和发展,早期研究表明,从树突状细胞(dendritic cel)这样的抗原呈递细胞分离外泌体,其细胞表面表达免疫相关分子如MHC I类和MHC II类,并通过激活免疫细胞,帮助诱导人类特异性免疫反应,最近,外泌体作为细胞—细胞通讯的介质作用逐渐显现,并且许多证据表明外泌体还调节免疫监控、组织修复、干细胞维持和血液凝固,此外,从被细菌感染的巨噬细胞释放的外泌体携带抗原和病原体相关分子模式,使其以TLR依赖的方式,通过巨噬细胞(macrophage)产生抗发炎功能(5)。
通过受体细胞的摄取,或者通过clathrin蛋白介导的内吞作用或通过胞饮作用的促进,可以有效地实现细胞间通讯,受体细胞可以在附近区域(旁分泌)或更远处,清除外泌体内的有毒分子,例如β-amyloid被认为是由小胶质细胞(microglia)和巨噬细胞介导所清除(6)。
越来越多的证据证实,外泌体与肿瘤发生、肿瘤转移、肿瘤血管生成和耐药性密切相关,恶性细胞具有诱导正常细胞变成癌细胞的能力,Poggio最近在Cell期刊的研究报告揭示: 携带免疫检查点蛋白的外泌体,通过损害T细胞活性而促进肿瘤进展,作者在小鼠体内系统的背景下,使用各种肿瘤细胞系和遗传方法,以显示破坏PD-L1表达或外泌体生物发生可支持抗肿瘤免疫,此外,他们的数据强化了抗PD-L1的免疫疗法,对携带PD-L1的外泌体活性较低的观点,这表明通过包含特异性靶向外泌体和外泌体PD-L1的药剂,可以使治疗方案更有效,最后,作者发现在一个肿瘤部位阻断外泌体的产生,会引起针对其他远程肿瘤挑战的全身免疫激活(7)。
随着基因组学的发展,外泌体的功能、治疗和诊断潜力的应用正快速发展。外泌体在维持正常生理功能以及疾病状态发挥重要作用,也因正常细胞和肿瘤细胞分泌的外泌体不同,因此外泌体可用为早期检测的标靶,例如外泌体中Glypican 1在胰脏癌患者血清中成阳性(8)。至目前为止,已有数十项以外泌体作为肿瘤标记物的研究进入临床试验。最后,外泌体在细胞外环境中的弹性使它们成为药物运送或疾病修饰分子(如病毒DNA或siRNA)的理想载体,可通过膜蛋白的基因工程靶向特定细胞类型或组织,一些以外泌体作为基础的药物也已进入临床试验阶段,因此,将来外泌体将更广泛地用于药物领域。
|
|
|
|
![Syntenin 1 antibody [GT1523] (GTX634154) Syntenin 1 antibody [GT1523] (GTX634154)](/upload/media/MarketingMaterial/Newsletter/2020/CN/exosome/pic05-1.jpg)
![CD63 antibody [MEM-259] (GTX28219) CD63 antibody [MEM-259] (GTX28219)](/upload/media/MarketingMaterial/Newsletter/2020/CN/exosome/pic05-2.jpg)