技术支持
WB问题排除
-
WB技巧与问题排除
-
三个WB遇黑点该做的事
Western Blot遇到黑点,莫急莫慌莫害怕,只要掌握3个关键问题, 就能完美呈现漂亮Western Blot! 
解决方案: a.确认奶粉完全溶解: 出现黑点最常发生的原因是奶粉没有完全溶解,建议加入搅拌子,增加搅拌时间,或是溶解后离心取上清液使用。 b.过滤溶液: 可使用0.45um过滤头过滤BSA或是用滤纸过滤奶粉颗粒或其他杂质。 c.改变缓冲液: 脱脂牛奶价钱便宜是封闭液的首选,如效果不好可换为成分单一的BSA或Casein。 
解决方案: 使用新鲜配制的溶液 (Running/transfer/blocking/wash buffers):使用现配或商品化的溶液减少因长菌长霉造成的黑点。 
解决方案: 一般脱脂牛奶中含有casein这种磷酸蛋白,可能会与磷酸化抗体产生非特异性结合,因此,如使用磷酸化抗体,建议用BSA作为封闭溶液,同时洗脱溶液也用TBST,如此可降低黑点或高背景值状况。 
1.TBST是以Tris为基底,PBST是以磷酸盐为基底的缓冲液,一般可以根据习惯选择TBST或PBST使用,如果是操作磷酸化抗体或是最终显色分析是用alkaline phosphatase (AP)系统时,因为PBST中的磷酸根会干扰,可能造成高背景值或无讯号,建议使用TBST缓冲液,另外,一次的实验中请用一种缓冲系统,不可blocking buffer用PBST,wash buffer用TBST。 2.封闭时一般使用3-5%封闭溶液,依实验特性不同,可做微调;牛奶与BSA的选择也是相同,掌握原则后,再依实验特性做微调,就能快速上手。 -
WB问题排除(一)-3个WB遇黑点该做的事

Western Blot遇到黑点,莫急莫慌莫害怕,只要掌握3个关键问题, 就能完美呈现漂亮Western Blot! 
解决方案: a.确认奶粉完全溶解: 出现黑点最常发生的原因是奶粉没有完全溶解,建议加入搅拌子,增加搅拌时间,或是溶解后离心取上清液使用。 b.过滤溶液: 可使用0.45um过滤头过滤BSA或是用滤纸过滤奶粉颗粒或其他杂质。 c.改变缓冲液: 脱脂牛奶价钱便宜是封闭液的首选,如效果不好可换为成分单一的BSA或Casein。 
解决方案: 使用新鲜配制的溶液 (Running/transfer/blocking/wash buffers):使用现配或商品化的溶液减少因长菌长霉造成的黑点。 
解决方案: 一般脱脂牛奶中含有casein这种磷酸蛋白,可能会与磷酸化抗体产生非特异性结合,因此,如使用磷酸化抗体,建议用BSA作为封闭溶液,同时洗脱溶液也用TBST,如此可降低黑点或高背景值状况。 
1.TBST是以Tris为基底,PBST是以磷酸盐为基底的缓冲液,一般可以根据习惯选择TBST或PBST使用,如果是操作磷酸化抗体或是最终显色分析是用alkaline phosphatase (AP)系统时,因为PBST中的磷酸根会干扰,可能造成高背景值或无讯号,建议使用TBST缓冲液,另外,一次的实验中请用一种缓冲系统,不可blocking buffer用PBST,wash buffer用TBST。 2.封闭时一般使用3-5%封闭溶液,依实验特性不同,可做微调;牛奶与BSA的选择也是相同,掌握原则后,再依实验特性做微调,就能快速上手。 -
WB问题排除(二)-3个WB遇过曝该做的事
一样米, 养百人, 同样做WB为什么我的结果总和别人不一样? 
解决方案: a.降低蛋白上样量: 通常蛋白上样(loading)量为30-50 ug,但有些蛋白表现量较高(如beta actin),此时可依蛋白表现量,调整上样量。 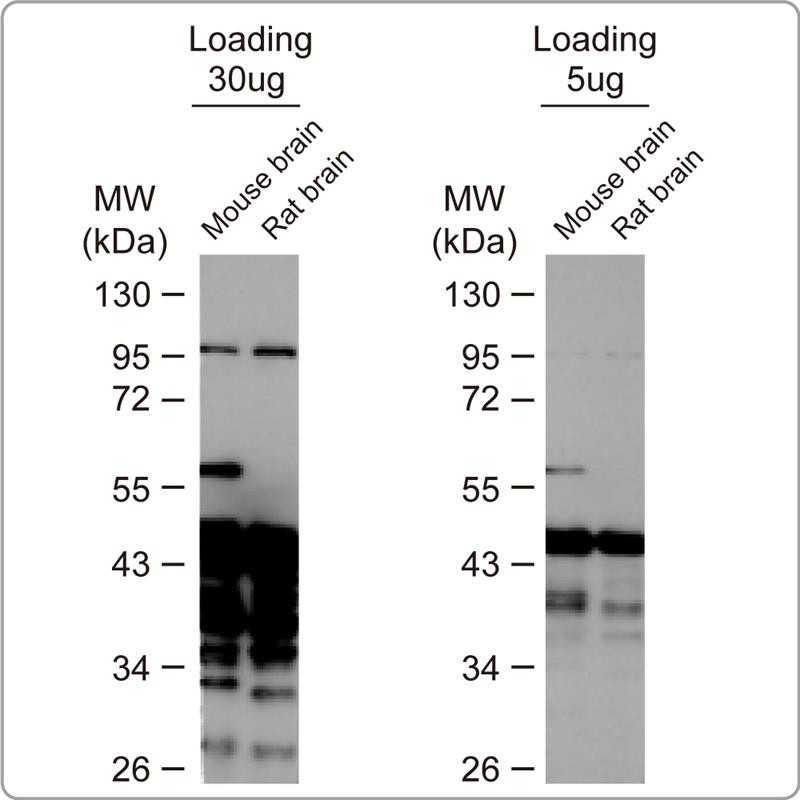

解决方案: a.增加抗体稀释倍数:产生过曝时可增加一抗、二抗的稀释倍数。 b.减少孵育时间 c.於4℃孵育 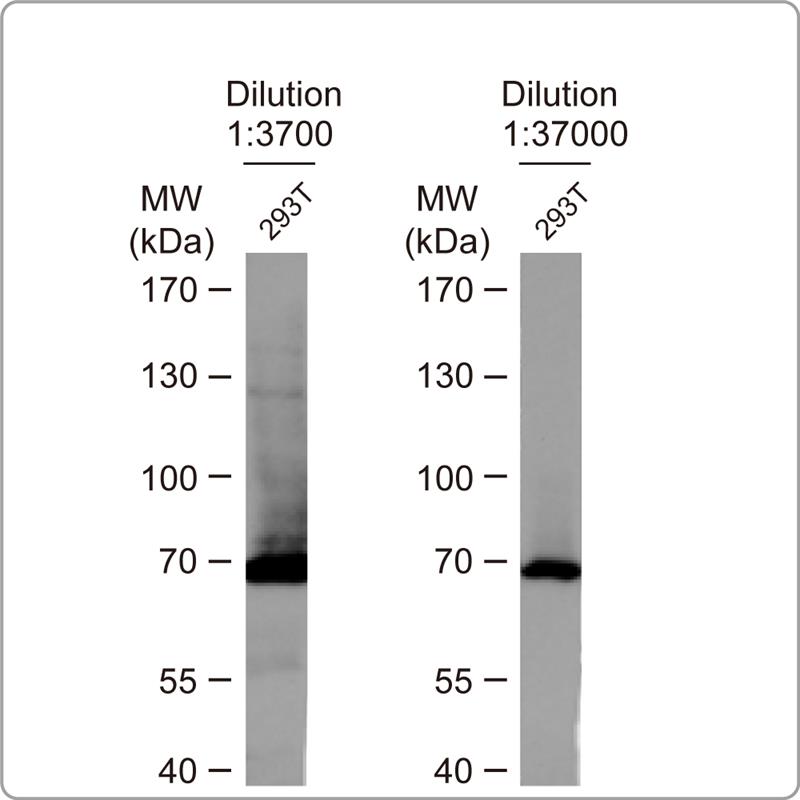

解决方案: a.缩短曝光时间:过曝时可缩短曝光时间,减少过曝的情形。 b.使用低灵敏度的ECL:过曝现象也有可能是因为化学发光底物过强导致的, 可选用灵敏度较低的化学发光底物来改善。 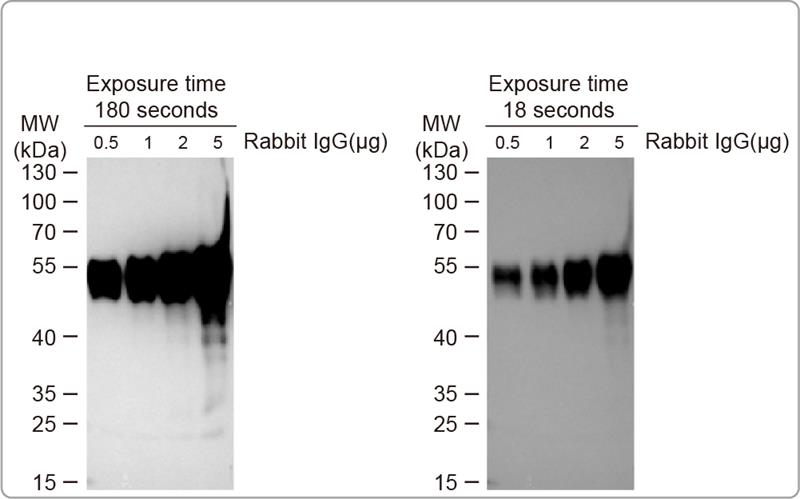

说明: 化學發光底物等級 
化学发光底物一般有三种等级,femto(飞克, 10-15g), pico(皮克, 10-12g), 及plus(低皮克级, 10-12~ 10-9g) ,可依蛋白表达量挑选适合的化学发光底物。 -
WB问题排除(三)-3个WB遇拖带该做的事
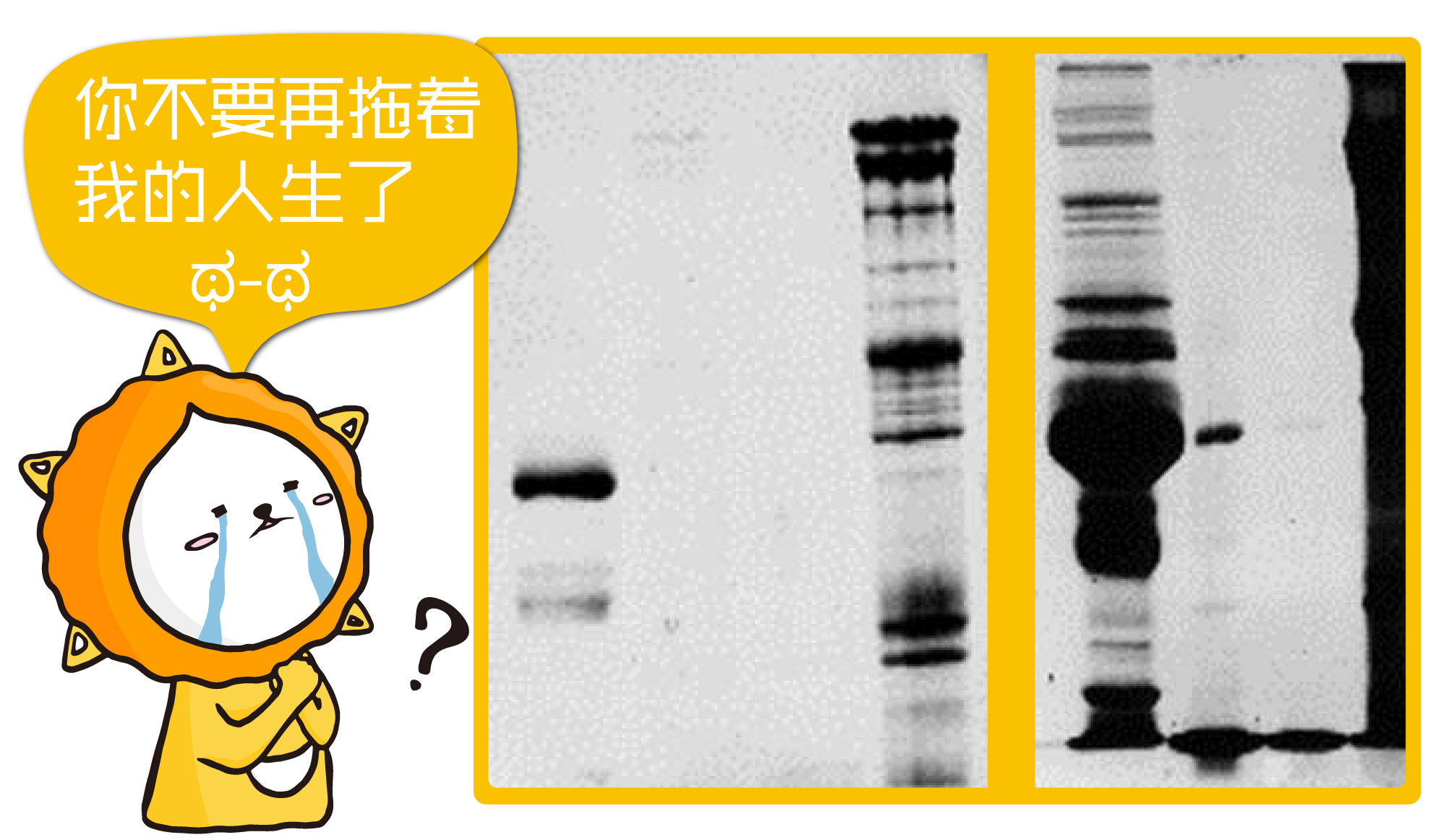
爱情忌讳拖拖拉拉, 拖拉的条带也让人心里不快, 怎样可以给个痛快呢?用下面的方式即可解决。 
泳道的条带之间出现像下雨一样的条纹, 原因是样品有盐类、蛋白、核酸或杂质的干扰,导致电泳过程中的电场改变。 解决方案: a.重新离心样品后取上清液使用 b.使用较纯的试剂配置细胞裂解液或购买商业化产品 c.使用Benzonase®核酸酶: Benzonase®核酸酶能迅速水解核酸,降低蛋白样品粘度,减少核酸对跑胶的干扰 d.全细胞或亚细胞萃取:使用商业化全细胞或亚细胞萃取试剂盒提取蛋白样品,减少配制试剂溶液以及操作中分离不干净的问题 
解决方案: a.降低蛋白上样量:通常蛋白上样量为30-50ug,但有些蛋白表达量较高(如beta actin),此时可依蛋白表达量,进行微调。 b.蛋白变性不完全, 也会使条带成团拖曳;此时,可通过将样品延长加热时间(一般约5分钟)及调整SDS(一般是2 %)比例, 使蛋白变性更完全。 
解决方案: a.缩短曝光时间: 过曝时可缩短曝光时间, 减少过曝的情形。 b.使用低灵敏的ECL: 过曝现象也有可能是因为化学发光底物过强导致的, 可选用灵敏度较低的化学发光底物来改善。 
▲化学发光底物一般有三种等级, femto(飞克, 10-15g), pico(皮克, 10-12g), 及plus(低皮克级, 10-12~ 10-9g) ,可依蛋白表达量挑选适合的化学发光底物。 另外,制备完下层胶后未用水或醇类覆盖胶体,当样品跑到堆栈层和分离层接口时,蛋白质发生沉淀,之后又随着跑胶过程慢慢溶解,也会形成垂直的条纹,此时只要在加入下层胶体前,用水或醇类覆盖压平就可以有好的结果。 
还有另一个与拖带现象类似的宽带。宽带其特征是条带较粗, 不紧实, 但没有雨状的拖尾,常出现在小分子量,建议用Tris-Tricine缓冲液系统取代Tris-Glycine系统。 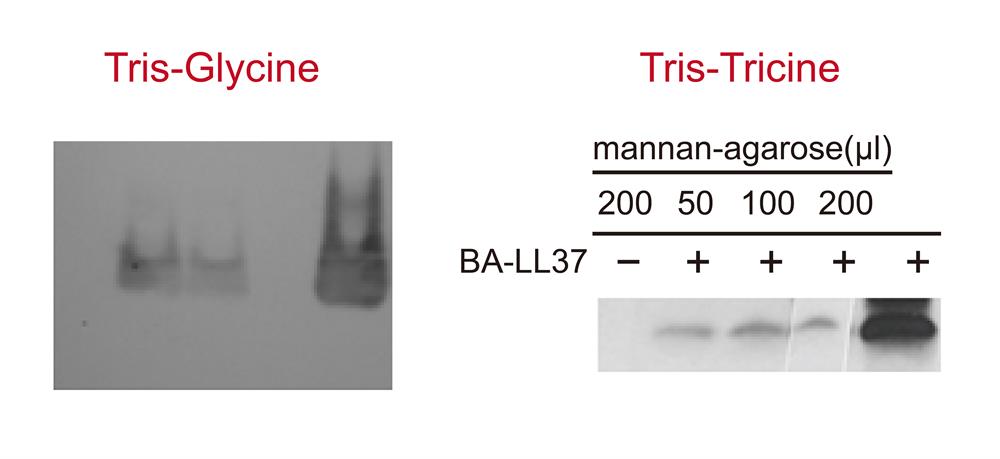
▲使用不同成分的胶体进行实验: 一般常用Tris-Glycine系统,另可根据需求或分子量大小调整,例如分子量<15 kDa,建议可用Tris-Tricine。 常用跑胶缓冲液系统: Gel type Selection criteria Running buffer Tris-Glycine General use Tris-Glycine Bis-Tris Small-to-medium protein size MES SDS Bis-Tris Medium-to-large protein size MOPS SDS Tris-Acetate Large protein size Tris-Acetate Tris-Tricine Small protein size Tris-Tricine-SDS ▲如已使用建议的缓冲液与跑胶百分比, 仍觉得条带太粗, 也可适时调整跑胶浓度。 
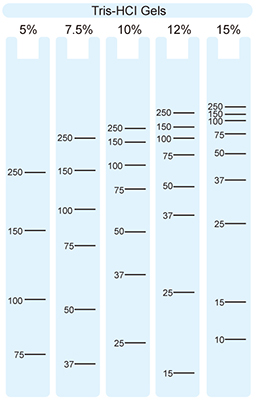
▲胶体百分比与位置 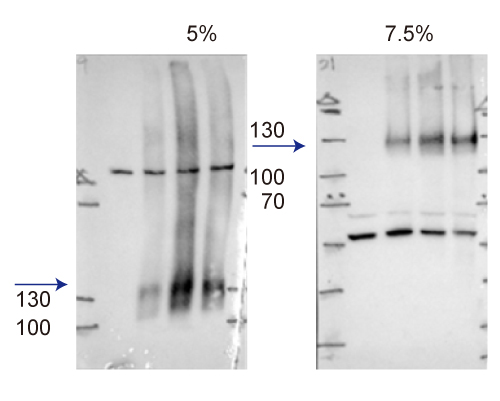
▲已有目标条带, 但觉得条带不够紧实, 可微调跑胶百分比。 -
WB问题排除(四)-3个WB遇扭曲该做的事

扭曲的线条在艺术上, 可以成为毕卡索 扭曲的线条在WB上, 总是让人不好说 

解决方案: a.确保APS & TEMED 正常, 并新鲜配置胶体 APS为起始剂,主要负责提供自由基供胶体进行聚合反应, APS粉末容易受潮,建议置于防潮箱保存,如果发生结块,建议买新的。溶解后的APS溶液,建议分装小量,并存放于-20度,取出后可于4度短暂保存,避免重复冻融,也可避免溶液污染,如胶体聚合不佳,可换一管APS溶液使用,或重新配置新的APS溶液;另外,TEMED为催化剂,如果过期或坏掉,也会影响胶体聚合,建议分装小量,避免溶液因多次取用而污染,APS与TEMED的比例也要根据胶体的浓度或体积进行调整。 b.小心移除齿梳,避免造成凹孔壁歪掉 c.配完下层胶后,需用水或醇类将胶体压平 d.胶里面有杂质/气泡:可预先用0.45 um滤纸过滤胶体溶液,混合胶体溶液时,应避免产生空气。 
解决方案: a.避免用高电压电泳使胶体过热。 150V,过热有雾气, 80-100V,上胶带短 下层不匀。 b.空的孔道加sample buffer,使每个孔洞都有样品且盐类成分相近。。 c.孔洞中有杂质,用高纯度等级的化学药品或用商业化试剂提取蛋白样品,也可以在上样前用跑胶缓冲溶液冲洗加样孔。 
解决方案: a.胶跟膜没有密合:轉磨時小心滚压胶体,使胶体与膜确實密合 b.有时出现 2个条带是因为转膜时晃到产生叠影 
条带呈哑铃状、骨头状或是长角 出现哑铃最大的可能是胶没有配置好,胶凝固后不均一,拔完梳子之后,某些孔道凸起不平整,可以试着注意胶体是否凝固完全(确认试剂没问题),拔梳子时注意不要让孔道歪掉,loading前也可以再用running buffer冲洗孔道,另外还有一种可能是样品中含有太多杂质,没有离心下来,或没有溶解,然后杂质沉积在孔的中间,蛋白因此被推挤到两边。 -
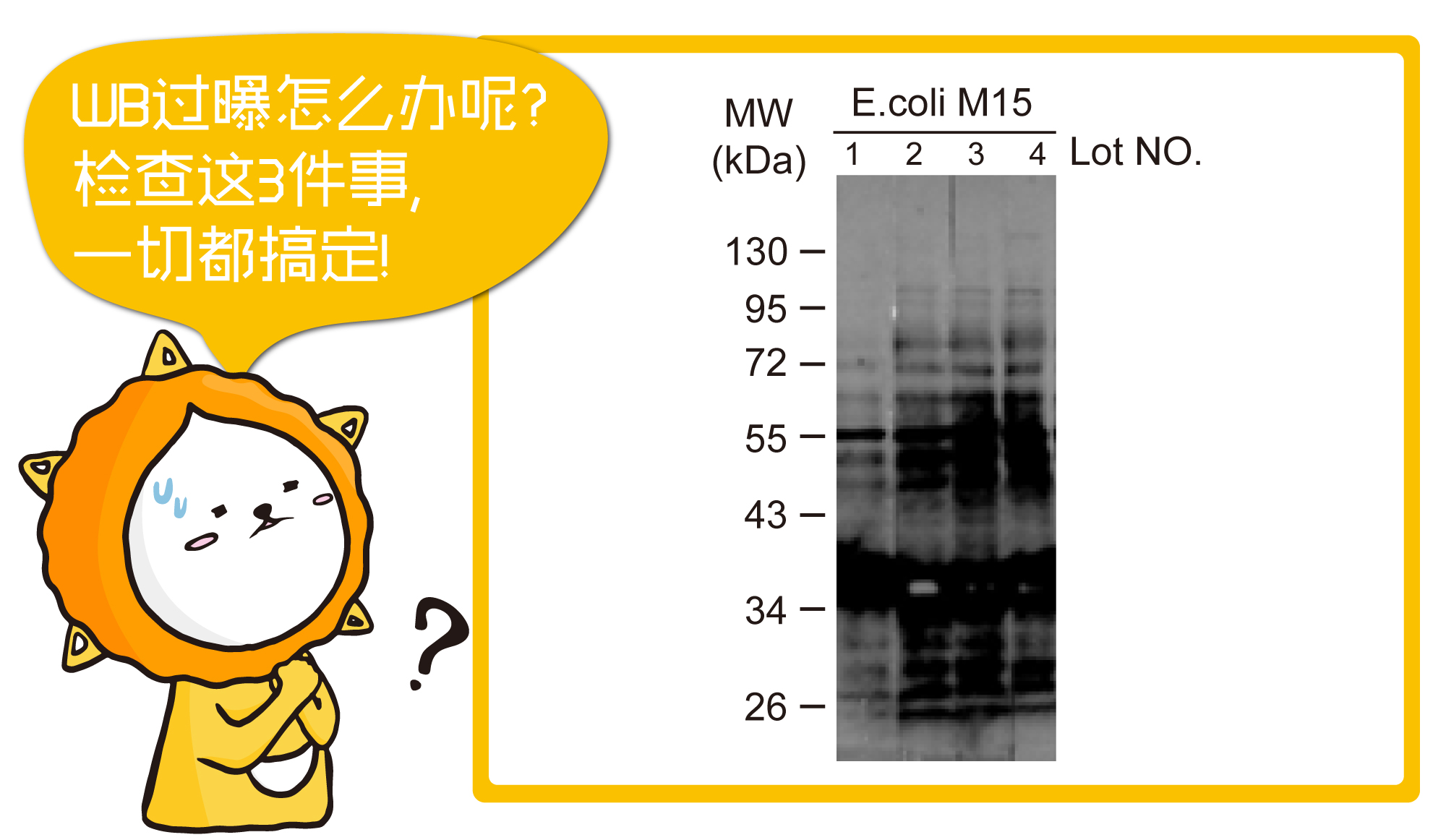
WB问题排除(五)-4个WB遇高背景值该做的事
Western Blot遇到高背景, 就像深山云雾, 有那么一点朦胧美, 却又想扒开云雾,一窥究竟。遇到高背景,只要掌握4个关键,即可烟消云散条带出。 
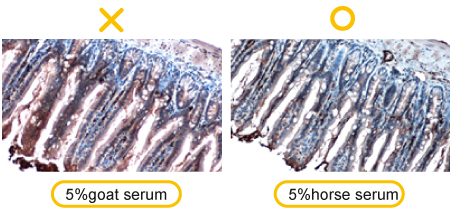
蛋白质转印到PVDF 膜或 NC 膜后,泳道与泳道间的空隙没有蛋白质;这时我们需要藉由额外的蛋白质缓冲液来填补其空白处。由于抗体本身也是一种蛋白质,因此若封闭作用不足,抗体可能会填进空白处的位置,进而造成高背景的结果。 解决方案: a.封闭作用不足:这是其中一种可能的原因,提高封闭物浓度可确保封闭液完全复盖转印膜,如使用5% 脱脂奶粉或BSA。 b.封闭液是否会与抗体反应:这种情况较常发生在磷酸化抗体的使用过程中,由于牛奶含有casein这种磷酸蛋白,因此如果使用牛奶当封闭液,可能会产生封闭液与磷酸化抗体有非特异性的结合。这个情况下,建议使用BSA作为封闭液,同时搭配使用TBST的洗脱液来帮助降低高背景值的状况。 c.封闭时间不够:增加封闭时间也可以降低高背景值的结果,一般情况会使用室温37度封闭1小时,可视情况调整封闭的条件。 
在WB实验时,较常见的transfer membrane是NC膜和PVDF膜;可依据蛋白特性、实验室经费,选择适合自己实验条件的材料。提供NC膜和PVDF膜的比较表: 
解决方案: a.没选到适合的膜 : 依据目标蛋白、想要呈现的实验结果及膜的特性,选择出适合实验的材料, 可参考上表。 b.膜干掉:这也会影响实验结果,产生高背景,建议整个实验过程都须注意让膜保持湿润,特别是PVDF膜。 c.膜没有完全均匀湿透:PVDF膜较会出现这个状况,使用PVDF膜前,需用100% methanol完全浸润膜。 
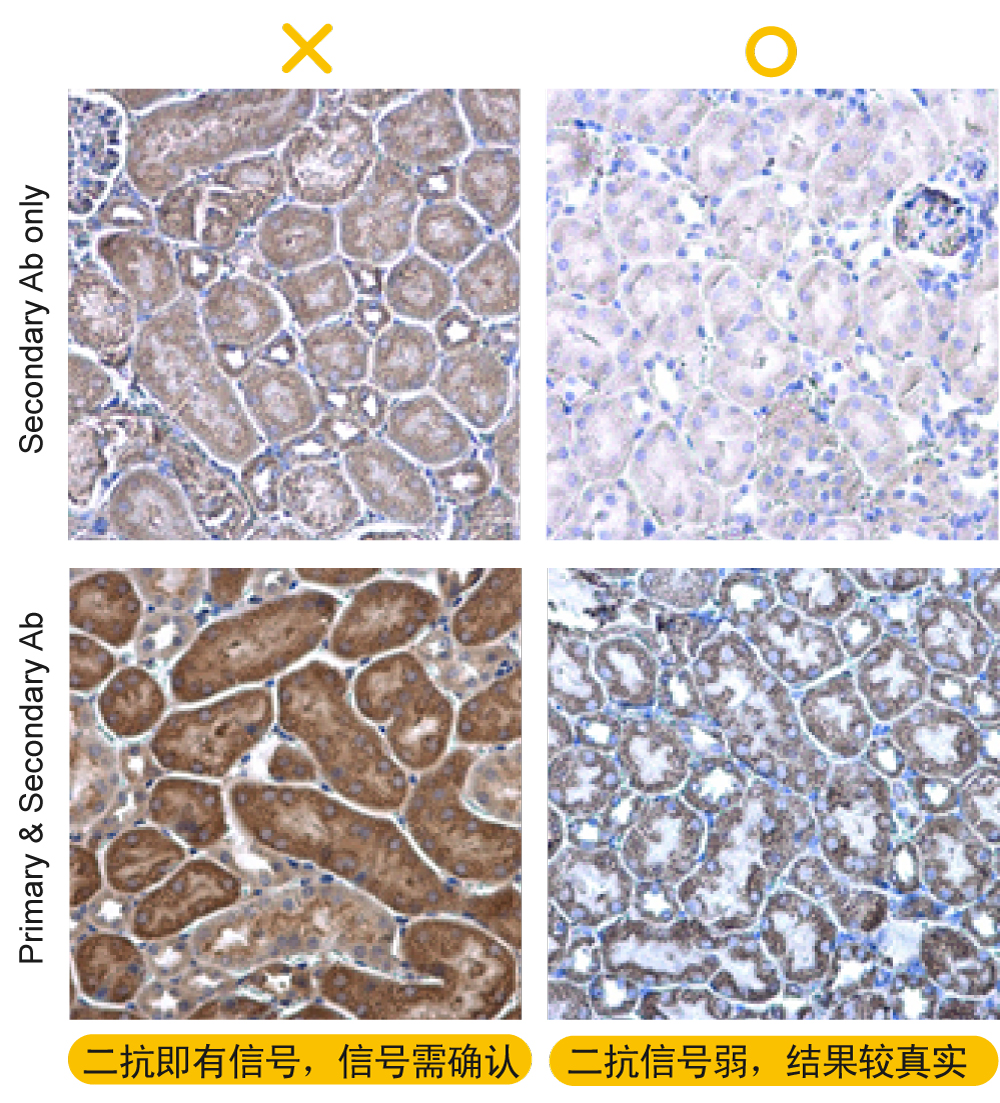
解决方案: a.封闭液及抗体交互作用:如同上述提到的,建议更换封闭液。 b.抗体浓度太高:建议降低抗体浓度,并增加洗涤次数和时间。 c.一抗孵育的温度:若偏高,抗体容易乱黏造成高背景值,建议4℃孵育过夜。 d.二抗的非特异性背景:可增加二抗对照,验证背景是否由二抗所致。 e.洗脱不足:容易造成高背景值,建议增加洗脱液体积和洗涤次数。 
解决方案: ECL呈色问题造成高背景值的原因,可能是因为化学显色底物过多;建议按说明书加入适量的显色底物。 化學發光受質靈敏度:化學發光受質一般有三種等級,femto(10⁻¹⁵g), pico(10⁻¹²g), 及plus( 10⁻¹²~ 10⁻⁹g) ,可依蛋白表達量挑選適合的化學發光受質。 
-
WB问题排除(六)-6个WB遇非专一性该做的事

1条2条3条, 到底哪一条是我的目标蛋白?非专一性条带看似复杂, 但只要使用注意2方向6小点, 就能找出问题, 快速解决。 

WB的结果如果目标蛋白条带下有许多条带,像下图, 有可能是蛋白降解造成的。 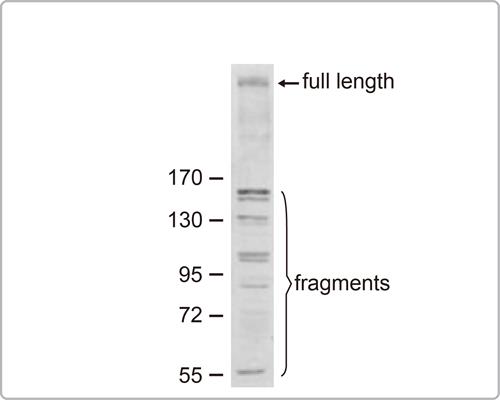
解决方案: a.细胞萃取时要加蛋白质抑制剂或磷酸酶抑制剂避免蛋白降解。 b.在冰上操作蛋白质实验。 c.避免重复冷冻解冻样品(建议分装);建议使用新鲜制备的样本。 
如WB出现多个条带且与目标蛋白分子量呈倍数增长,有可能是蛋白形成多聚体。 
解决方案: a.如果多聚体是以双硫键键结而成,可使用现配的 DTT / 2-ME并将加热时间延长,这可帮助打断多聚体的双硫键。 b.建议一并确认煮样本的温度是否足够,若煮样本的仪器是电子显示其加热温度,建议可以增加温度计辅助确认温度确实有达到95-100℃。 
WB如果出现多条带且没有特定规则, 可进一步查询文献确认蛋白质是否有后修饰、剪切体等。 解决方案: a.HIF1 alpha其蛋白的预测分子量是93 kDa,不过由于蛋白后修饰作用的原因,观察到的分子量会在120-130 kDa,也可能会因为不同样本的后修饰作用程度不同,而出现更高的位置。一般判断后修饰分子量的方式会和对照组做比较,其多出来的条带很有可能都是目标蛋白。 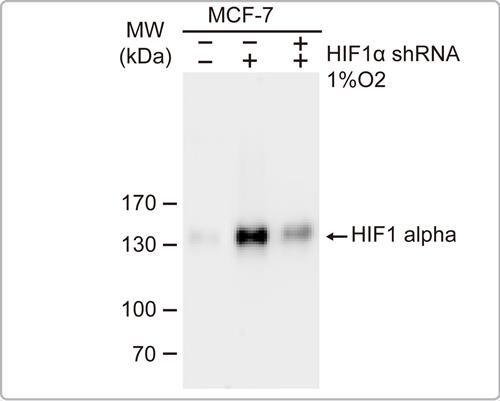
▲GTX127309使用加药处理可看到HIF1 alpha表达量增加, 使用基因静默也可看到信号减弱,证明此抗体辨识的为HIF1 alpha。 b.Caspase 3其蛋白会有剪切体,如果抗体的抗原位置是设计在剪切后的位置,且抗体特性并非只会认别剪切后的蛋白,此时就有可能会同时出现未剪切及剪切的多条带,这些并条带并不是非专一性条带;甚至, 有时这些条带的多寡也会和细胞培养条件有些相关。 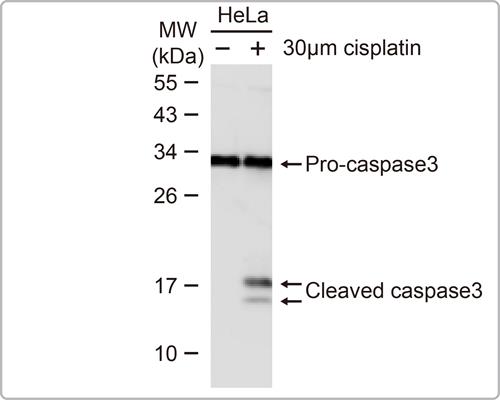
▲在cisplatin处理下, caspase 3出现未剪切及剪切体的多条带。 

WB结果如果发现泳道和泳道间的缝隙不见了(左图)或出现一团黑(右图)的结果,有可能是蛋白样品过量或一抗浓度太高造成。 
解决方案: a.一般蛋白上样量为30-50μg,如果仍出现此情形,建议可减少上样量。 b.调整增加抗体的稀释倍率,也可调整孵育时间,并使用4℃孵育的孵育温度。 
解决方案: a.洗涤条件:增加洗膜次数与时间或在洗涤液里改用不同强度的detergent或是增加浓度。 b.设对照组来确认抗体非专一性结合可能的原因,例如:实验用的细胞样本里是否有高度表达其内生性目标蛋白表现量。 c.可询问抗体公司是否有任何数据支持其结果。 
解决方案: 这种情况通常发生在IP实验里,GeneTex有一系列可避免辨认heavy/light chain的特制二抗,其设计原理是用来辨认native的一抗结构。 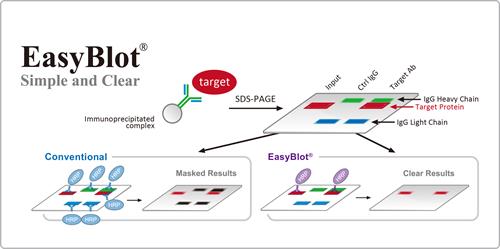
▲EasyBlot二抗与native form的一抗有较好的专一性,可减少辨识膜上的denature form 一抗。 -
WB问题排除(七)-5个WB遇信号微弱该做的事


解决方案: 
a.目标蛋白是否有细胞器特異性? 可提取特定细胞器增加蛋白浓度;例:抽取核蛋白、膜蛋白、质蛋白。 b.目标蛋白是否有组织特异性? 有些目标蛋白只会在特定的组织表达,这可降低样本挑选的错误率。 c.目标蛋白是否有后修饰作用? 目标蛋白后修饰分子量会变大,使抗体认到的位置比估算分子量高。 d.确认目标蛋白在细胞株的表达量以及是否需加药活化蛋白表达。 e.文献较少的目标蛋白,可参考其mRNA的表达量,寻找mRNA表达量较高的细胞株进行实验,不过须注意mRNA和蛋白的表达量不一定是正比关系,或许可以挑选组织样本和细胞株一起比较。 f.参考抗体厂商提供的产品信息,例如:抗体测过的样本当作阳性对照,可作为操作问题或是蛋白不表达的依据。 
一般蛋白上样量为20-30μg/孔, 如文献已表明目标蛋白表达量低或是使用极少的上样量(例如< 10μg), 需增加上样量来协助抗体侦测其信号。 
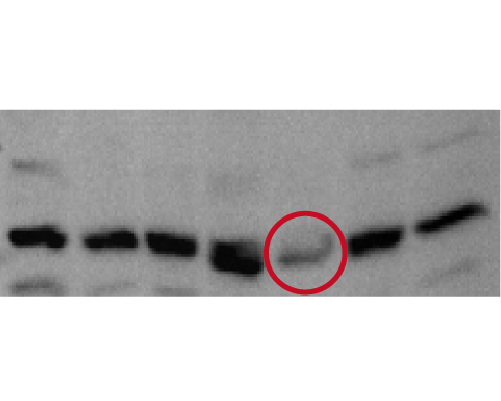
蛋白质降解可使条带变弱甚至无法重复之前的结果(如下图) 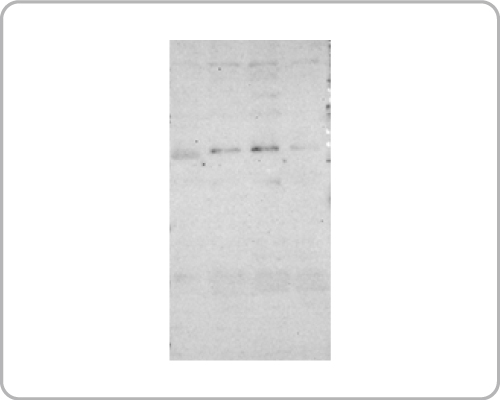
为避免这个情况的发生,可使用以下的方法来避免: a.细胞萃取时要加蛋白质抑制剂或磷酸酶抑制剂,避免蛋白降解。 b.在冰上操作蛋白质实验。 c.避免反复冻融样品(建议分装)。 d.新鲜制备新一批的样本。 
解决方案: 
a.增加抗体量, 例如原本使用1:1000稀释, 调整为1:500稀释。 b.增加孵育时间:将原37度孵育1小时改成4度孵育过夜。 c.确认抗体有没有异常, 例如: 重复使用太多次, 失去活性;NaN3加到二抗缓冲液里会降低呈色剂灵敏度。 
检查二抗与一抗种属是否有正确配对,要诀: ”鼠配鼠兔配兔, isotype相配不出错”。 
降低清洗次数与时间:一般清洗三次, 每次5-10分钟即可。 
解决方案: 
如果转膜方向错误会让蛋白会往反方向移动进而散逸在transfer buffer里,方向正确才能让蛋白黏附在transfer membrane的孔洞。 
如果使用PVDF膜,需先浸MeOH使膜活化才能使用。 
a.大蛋白: 转膜条件可调整为低温过夜(湿式transfer)。 b.小蛋白: 可更改使用 0.2 μm 的transfer membrane,并缩短转膜时间。 
转膜后,需使用丽春红(Ponceau S)等染剂染膜确认转膜效率,如下图: 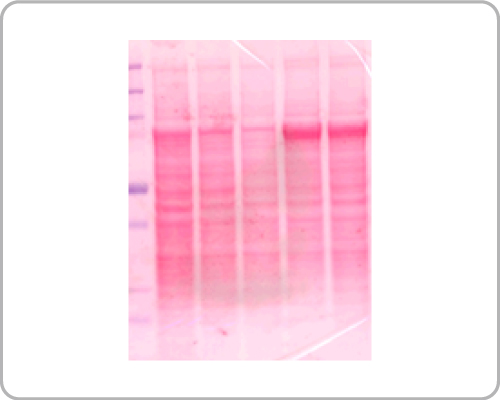

解决方案: 
a.降低封闭液浓度:一般使用3-5%的牛奶或BSA做封闭液即可。 b.降低封闭时间:一般封闭时间为30-60分钟。 c.抗体如跟封闭液交互作用,也可能因抗体被中和而造成白片,此时可换封闭液解决,例如使用commercial Blocking Reagent (GTX30963)可协助避免这个问题的发生。 
化学发光底物失活,也可能导致条带变弱。 解决方案: a.使用现配的化学发光底物, 避免失活。 b.使用高敏感度的化学发光底物,例如使用 femtogram (GTX14698)等级的化学发光底物。 c.延长压片时间。 -
瞬间消除胶上气泡的小妙招
-
关于内参你该问的事
什么是内参
Western Blot常用来比较不同条件下或不同细胞组织中目标蛋白表达量的相对多寡,因此必须先确定上样量相同,才有比较的基础。在Western Blot实验中,可能因总蛋白浓度测定不准确;或是蛋白质上样时因操作产生误差,所以必须设置内部参照组来进行校正。此内部参照必须在不同细胞或组织间表达相对恒定,且有高水平的表达量,来确保不同样品间蛋白定量相同。而这样的参照蛋白,就称为内参,对应的抗体就称为内参抗体。
内参在WB实验中的重要性
- 用于校正蛋白水平,确保不同样品间蛋白定量(上样量)相同。可从条带粗细初步判定上样量是否有差异。进一步,使用影像分析程序将目标蛋白量除以内参含量,所得到的数值即为校正后的目标蛋白相对含量,如此就可以进行目标蛋白相对量的比较。
- 确认转膜、显色等步骤是否均匀转移,呈色。内参一般选用高表达的蛋白,因此也可通过内参的条带, 观察WB实验中的转膜、显色等步骤是否有异常。
- 对文章发表绝对重要,增加实验的可信度。文章内放上内参的数据,较有说服力,文献审核者也会较相信实验数据。
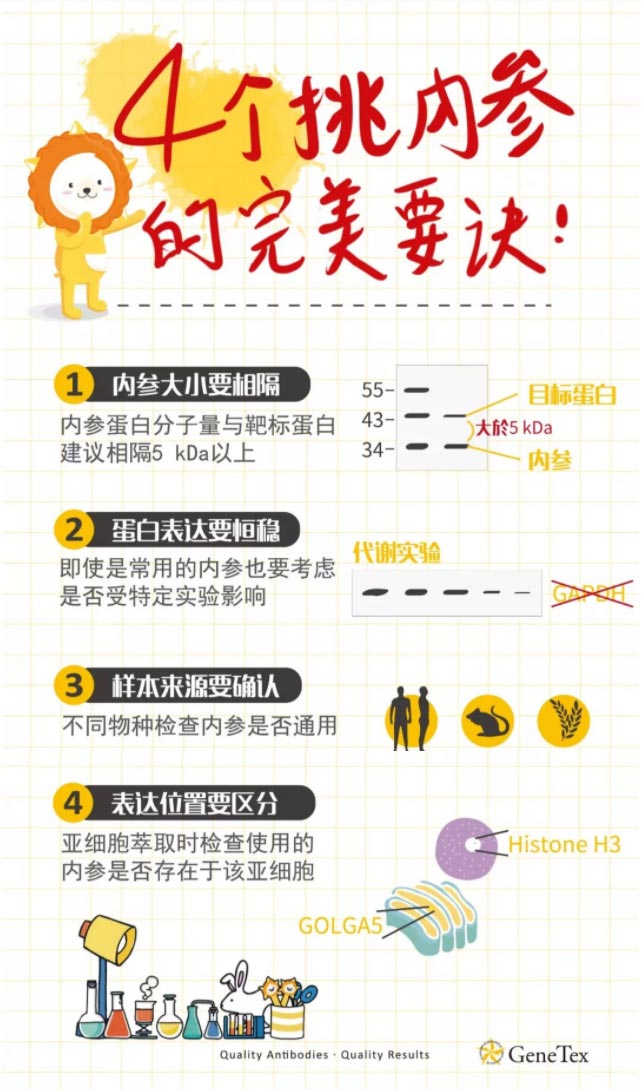
如何挑内参抗体
通常会挑选各细胞或组织间稳定表达、并且不受实验影响的蛋白作为内参,但不同的实验还是有一些细节要注意,挑选内参可参考下面四点:
研究的蛋白分子量?
选择内参抗体时,应考虑分子量。内参蛋白最好能与目标蛋白的分子量有5 kDa以上的差异,在WB实验中能做区隔。分子量若太过接近,不利后续条带的分析。例如目的蛋白分子量为34 kDa,则可考虑选择分子量19 kDa 的Cofilin 1,不宜选择34 kDa GAPDH作为内参。




![Cyclin D1 antibody [N1C3] (GTX108624) Cyclin D1 antibody [N1C3] (GTX108624)](/upload/media/MarketingMaterial/Newsletter/2020/CN/190911/pic01-1.jpg)
Cyclin D1 antibody [N1C3] (GTX108624)




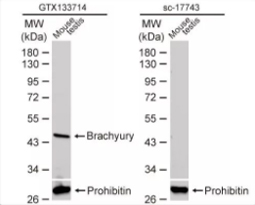
Brachyury antibody (GTX133714)

研究的領域?
挑选的内参是否会受实验变化影响,例如GAPDH是常用的内参,但在代谢糖酵解的研究中,可能就不适合做内参;在凋亡实验时,TBP、Lamin A + C等与凋亡相关的因子也不适合作为内参。内参最好是选择在正常状态和病理状态下表达没有明显差异的蛋白,这也是大家最容易忽略的一点。
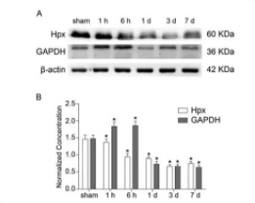
说明:创伤性脑损伤后,GAPDH显著降低,建议以beta actin做内参(PMID: 30077728)
![GAPDH antibody [GT239] (GTX627408) GAPDH antibody [GT239] (GTX627408)](/upload/media/MarketingMaterial/Newsletter/2020/CN/190911/pic01-4.jpg)
GAPDH antibody [GT239] (GTX627408)

研究的材料?
- 哺乳动物的组织或者细胞样本,通常选择β-actin、GAPDH、COX4、Histone H3等。
- 其他来源样本应该参照文献,选择合适的蛋白作为内参,例如植物样本可用bata actin,Ubiquitin,Rubisco作为内参
是否使用亚细胞萃取?
一般的蛋白检测常用β-actin、GAPDH抗体等,如针对核蛋白定量,常用的核内参抗体有Lamin B、Histone H3、PCNA。
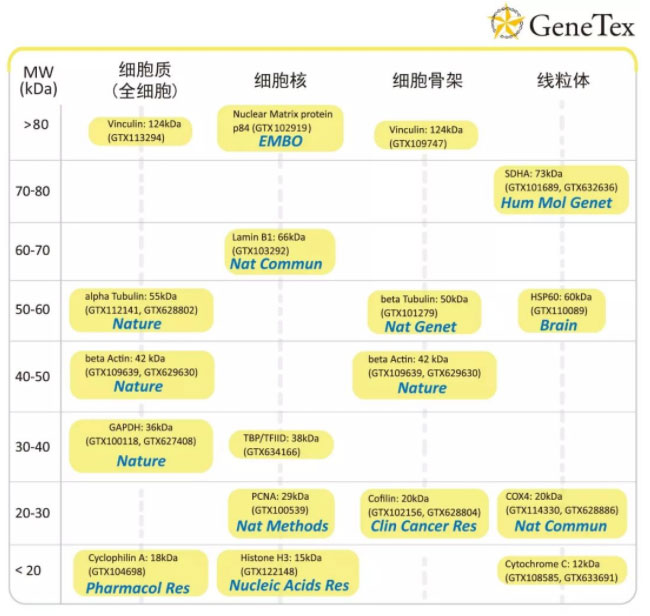
常用内参一览表
-
蛋白质印迹技巧和窍门 | 不可不知的NC膜保存法
-
蛋白质印迹技巧和窍门 | 半干转膜与抗体反应
-
蛋白质印迹技巧和窍门 | 加速您上样!
-
蛋白质印迹技巧和窍门 | 电泳
https://v.youku.com/v_show/id_XNTgwMDA4NDEwNA==.html?spm=a2hbt.13141534.app.5~5!2~5!2~5~5~5!2~5~5!2~5!2~5!2~5~5!2~A&scm=undefined.undefined.undefined -
蛋白质印迹技巧和窍门 | 样品制备
IHC问题排除
-
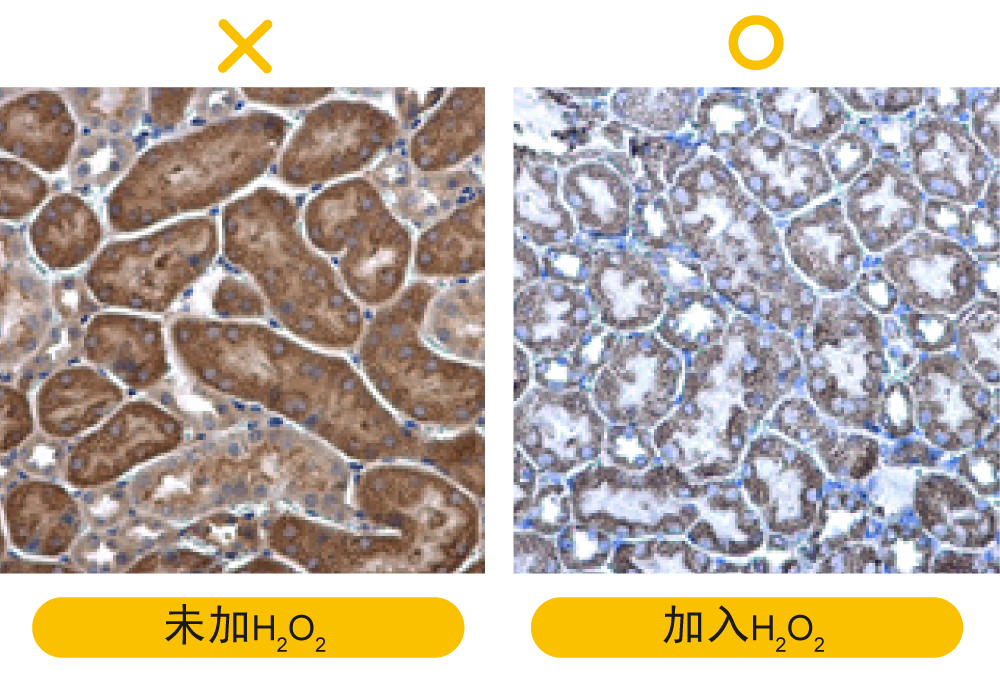
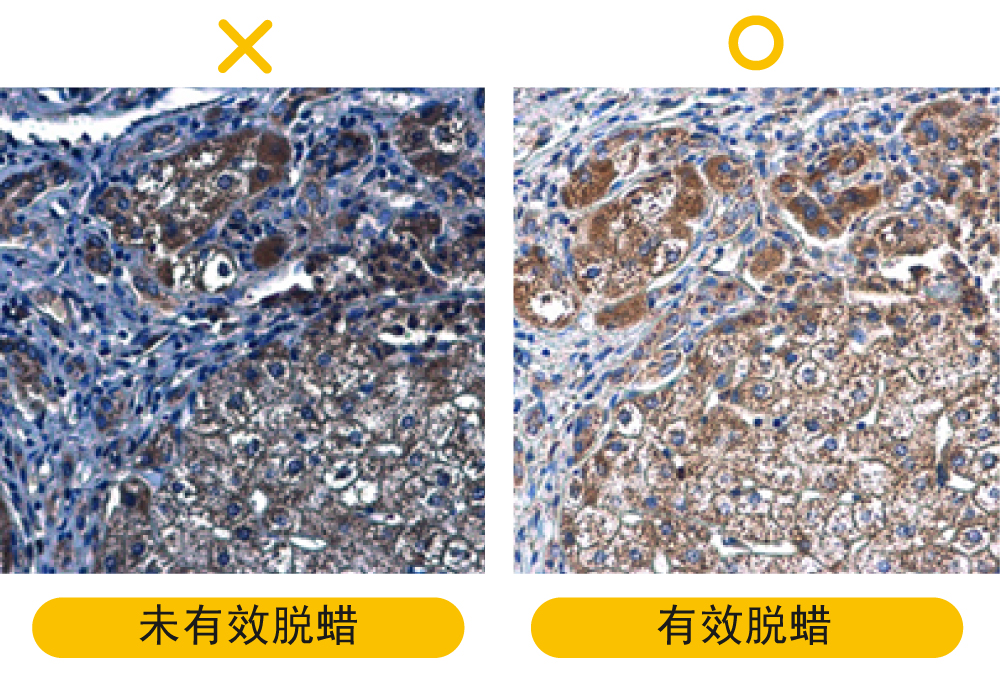
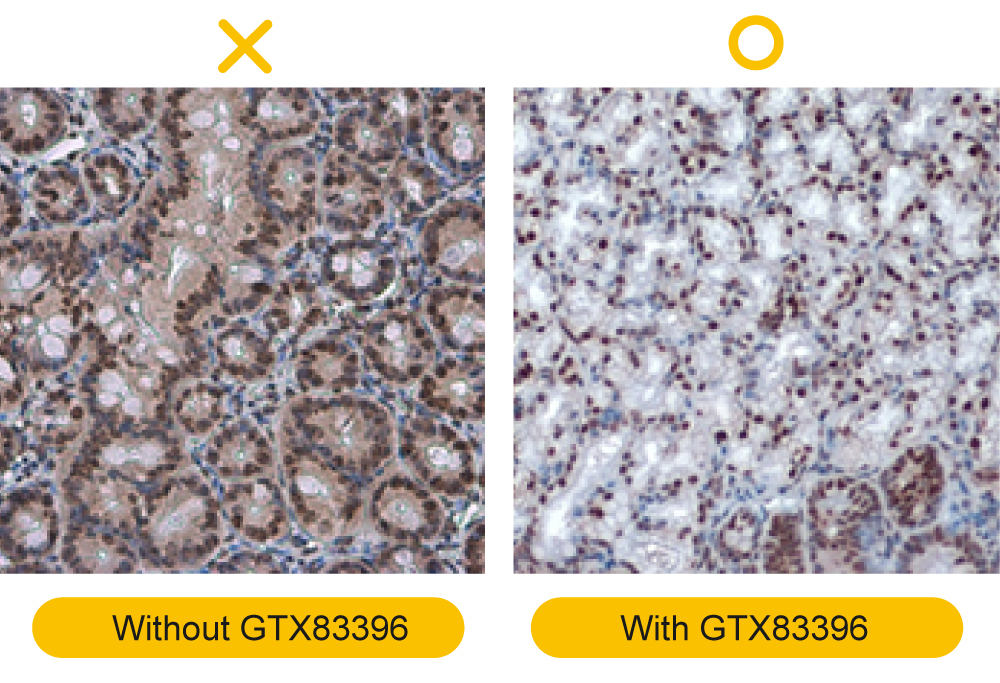
IHC问题排除(三)-4个IHC讯号微弱该做的事


解决方案: a.一抗二抗未匹配:使用针对一抗物种来源的二抗 (如一抗来自兔子,则须使用抗兔子的二抗。 b.使用的抗体可能不适合用来做IHC:在非変性 WB 上测试抗体, 以确保抗体识别非变性抗原,或是选用通过IHC实验验证的抗体。 c.没有添加足够的抗体:增加抗体浓度,加长孵育时间,一般建议在4°C过夜孵育。 d.抗体失活:避免将标记荧光基团的二抗放置于光照环境。 
解决方案: a.显色溶液失去作用:通过将二抗标记酶, 取一滴与底物溶液反应, 可确认显色溶液是否失去活性。 b.错误的激发波长:确保激发波长与使用的荧光基团相匹配。 
解决方案: a.脱蜡作用不足:加长脱蜡时间,使用新鲜配制的二甲苯。 b.固定液(福尔马林或 PFA) 可能改变表位:利用抗原修复方式使表位暴露出来或缩短固定作用的时间。 c.直接以30%蔗糖溶液进行脱水,导致脱水过度:建议确实操作渐进式脱水步骤,循序增加蔗糖溶液的浓度,降低脱水时对组织的破坏。 d.固定作用不适当:避免延迟固定或过度固定,一般建议至少固定6小时以上,18~24小时已可满足大多数实验应用。 e.冰冻切片样品保存期过长:冰冻切片制备完成后,最好于1-2个月内用完,超过6个月的话,建议制备新的玻片。 f.荧光染色样品保存不当:荧光基团在光线下暴露时间过长,可能会导致信号衰减,除了在避光环境下进行实验和保存样品,也可使用防荧光淬灭的溶液封固样本,如GTX30920与GTX30921 FluoroShield Mounting Medium,是封片剂也具有复染功能,在做复染的时候,连片子都封固好了,下图皆为使用GTX30920封固的玻片影像。 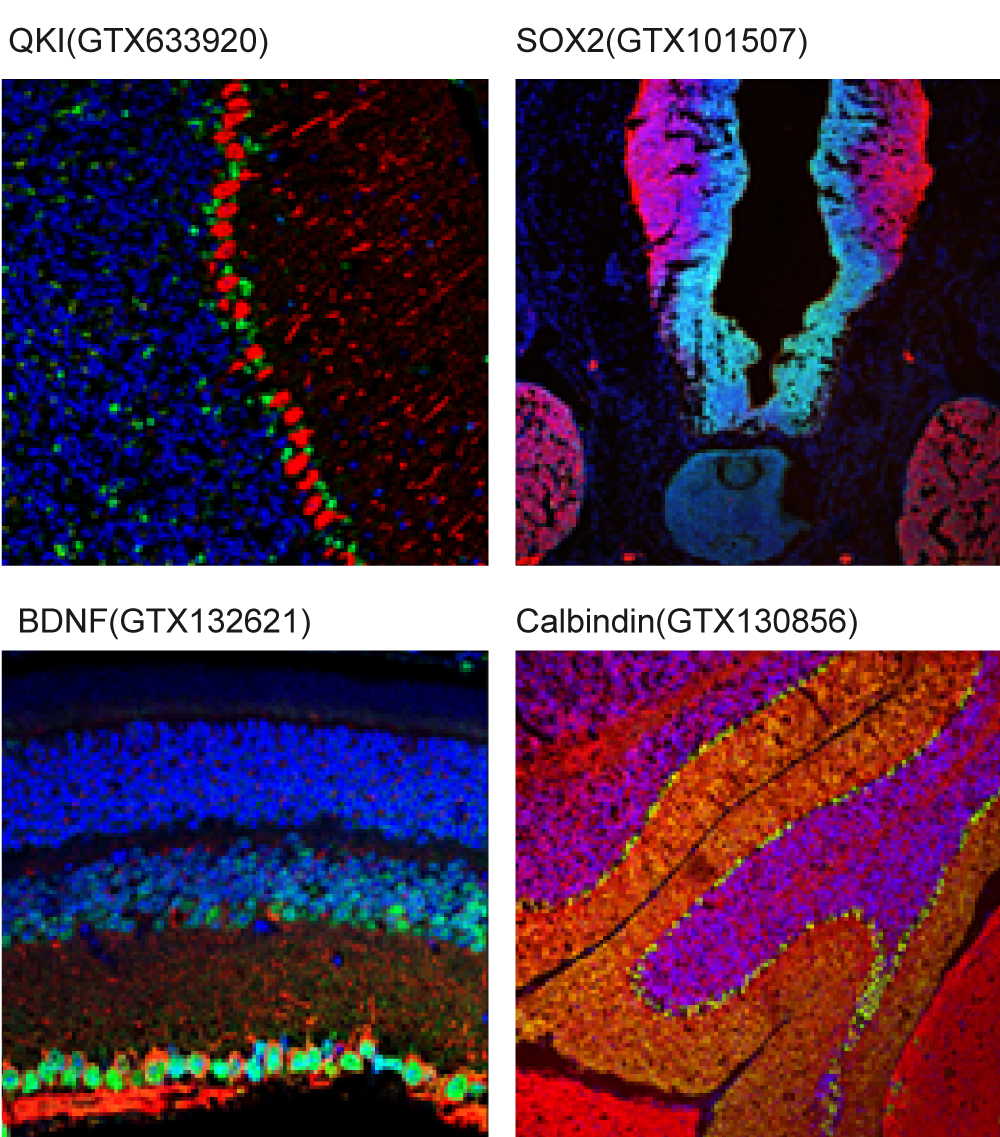

解决方案: a.靶蛋白含量低:设置表达量高的组织作为阳性対照组,或利用扩增步骤来放大信号。 b.靶蛋白为核蛋白:在封闭溶液与抗体稀释液中加入细胞破膜试剂,以促进抗体渗透到细胞核(应针对每种靶标调整最佳的破膜方法)。 c.膜蛋白被破坏:将缓冲液中的细胞破膜试剂减少或移除(应针对每种靶标调整最佳的破膜方法)。 d.较厚的组织,如斑马鱼全胚胎或染色建议做细胞破膜,这样抗体就能顺利进入胞内与相应抗原结合(应针对每种靶标调整最佳的破膜方法)。 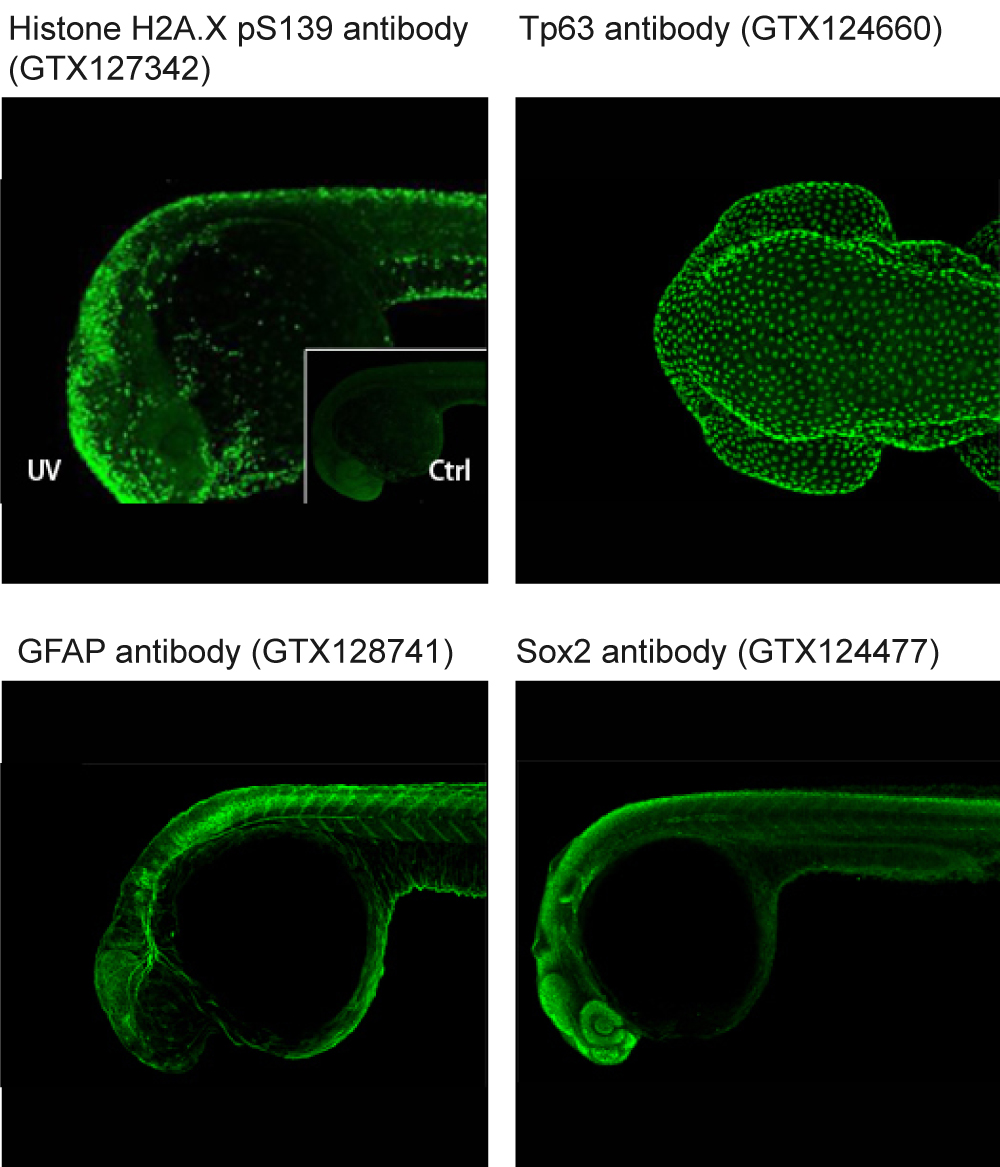
关键步骤: 在每次的实验中,设置阳性与阴性对照组,以确认是该次实验的抗体、试剂、组织切片、实验过程的问题,还是目标蛋白本身表达量低的问题。 -
IHC问题排除(二)-6个IHC高背景值该做的事
-
IHC问题排除(一)-6个IHC型态不佳该做的事


解决方案: a.使用新鲜配制、适当带电(如: Poly-L-lysine)或疏水(如: Silane)处理过的载玻片(处理方式不同对组织的贴附效果也不同)。 b.石蜡切片贴于载玻片后,于60°C烘烤3-5小时最为合适,烘烤不足容易掉片。 c.过程中轻柔冲洗载玻片上的组织。 
解决方案: a.切片刀钝或是刀刃上有缺口:使用锋利刀片重新制备切片。 b.刀刃上有蜡屑的积留:随时将废屑残渣用毛刷清除干净。 c.刀没夹紧或刀的角度倾斜:适当调节切片刀的角度,并确认刀片和蜡块都有夹紧。 d.移动刀座,如果划痕还是出现在相同位置,应该是组织标本内有污物或硬物的问题。 e.确认组织无过度脱水,并调节适当切片速度。 f.在分析实验结果时,避免损坏切片区域。 g.避免展片时于载玻片上形成的气泡。 
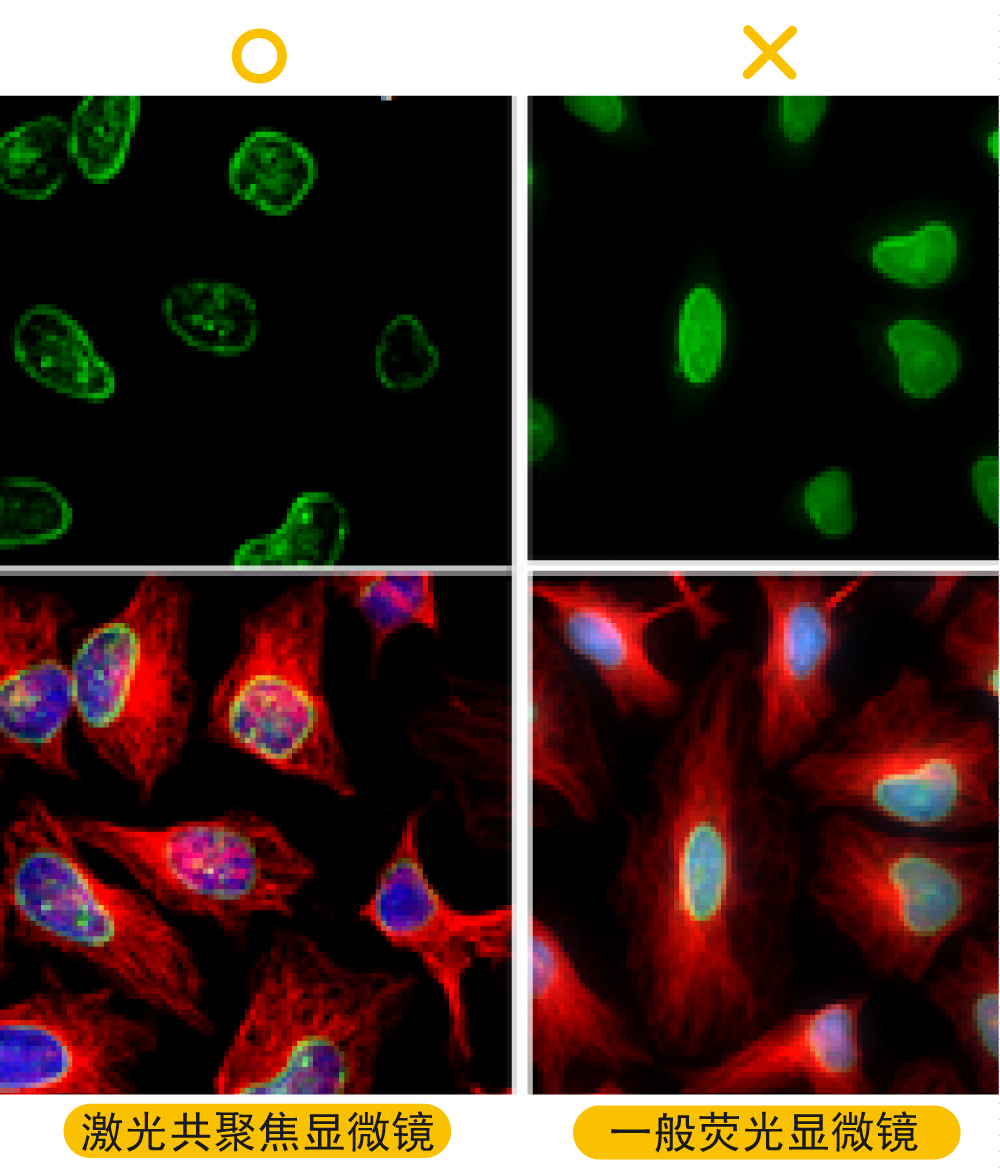
解决方案: a.制备较薄的切片:一般来说,冰冻切片的片子较厚(约10-30 um),一般设定刀片温度为-10~-20度,如设定太冷,可能会切不好;如切片厚度大于30 um(30-50 um),建议将一抗孵育的时间延长至两晚。石蜡切片的片子较薄(约5-10 um)。 b.确认已使用适当厚度的盖玻片(通常,生物物镜设计的盖玻璃厚度为0.17 mm),如使用油镜一定要滴油。 c.建议使用激光共聚焦显微镜成像,去除非焦点平面的噪质。 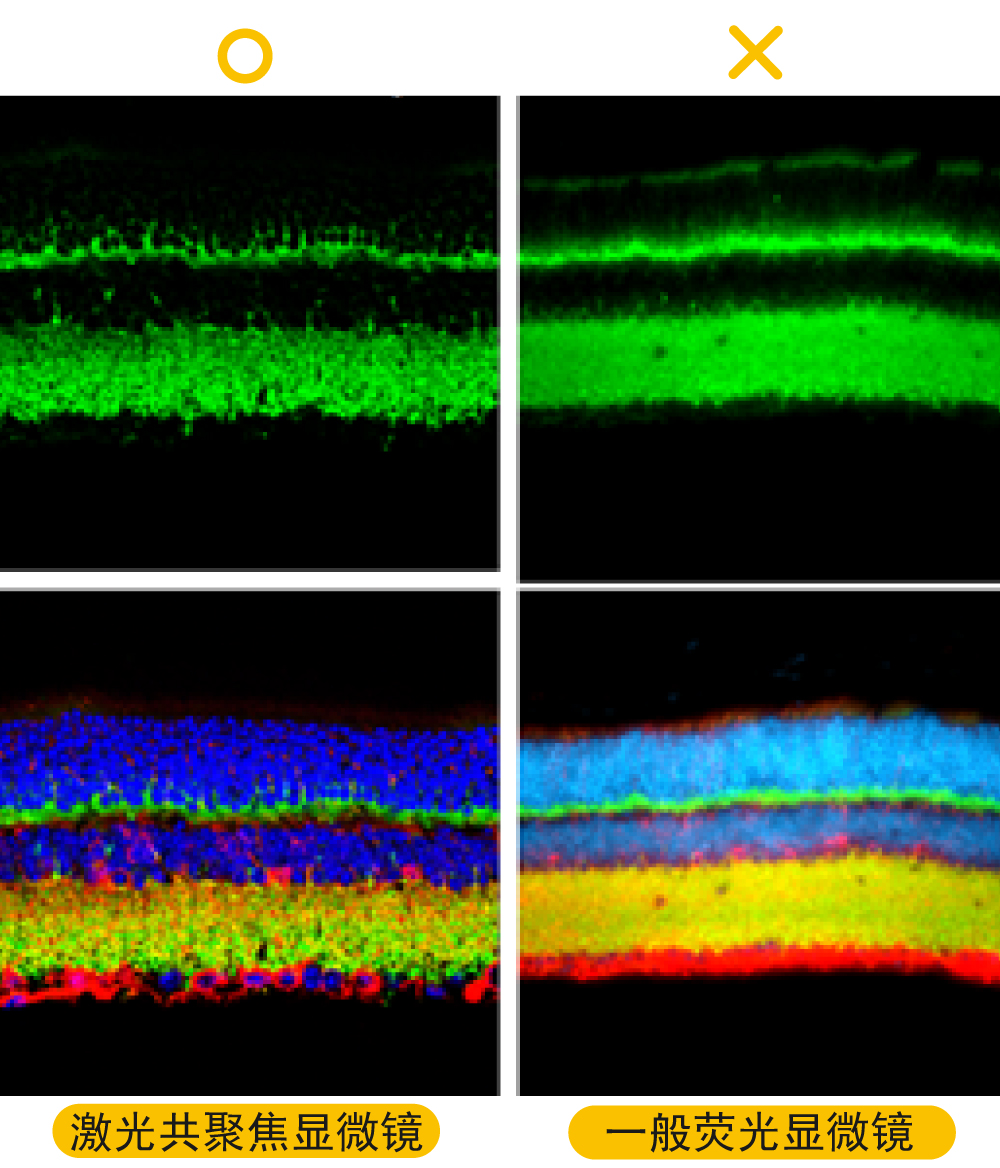

解决方案: a.如使用4 % PFA,一般建议至少固定6小时以上,18~24小时已可满足大多数实验应用,可依据染色结果增加固定时间与/或加入后固定的步骤,注意:如固定时间到了无法继续后续脱水、包埋程序,一定要将组织置换到PBS保存,切勿一直泡于固定液中。 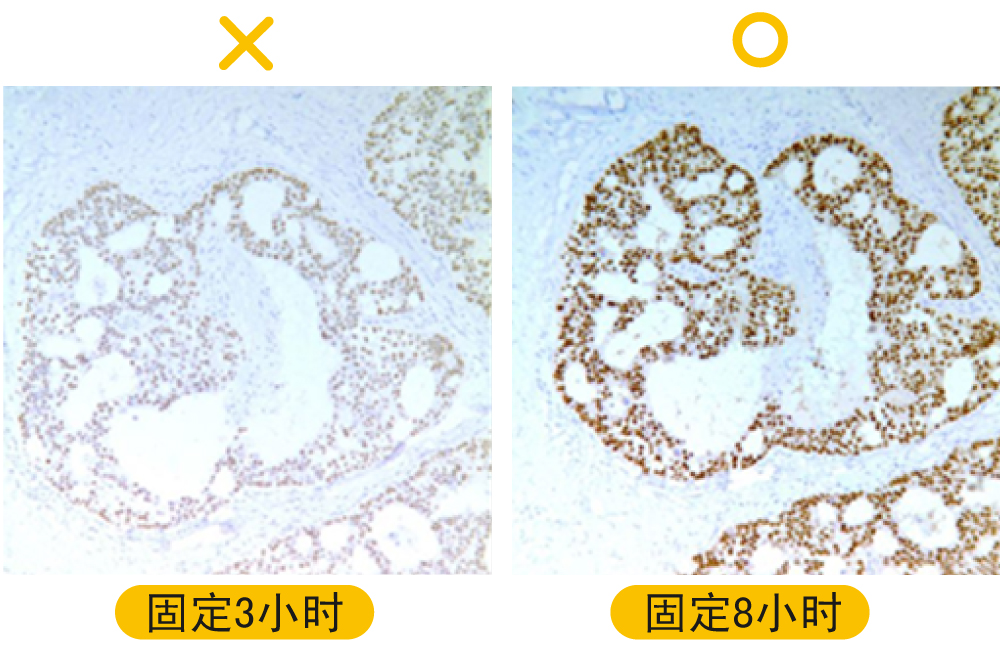
b.增加固定液/组织比例,建议固定液体积至少要是组织块的20倍体积。 c.准备较小的组织块(约3-4 mm),以迸行更完全的浸润固定。 
解决方案: a.凭经验决定保留组织型态的条件,同时恢复抗原的免疫反应性:理论上温度越高,酸碱值越碱,但可能造成较高的背景值或组织型态破坏,因此,建议从92°C, pH6开始尝试,pH6的抗原修复液即适用于大多数抗体。 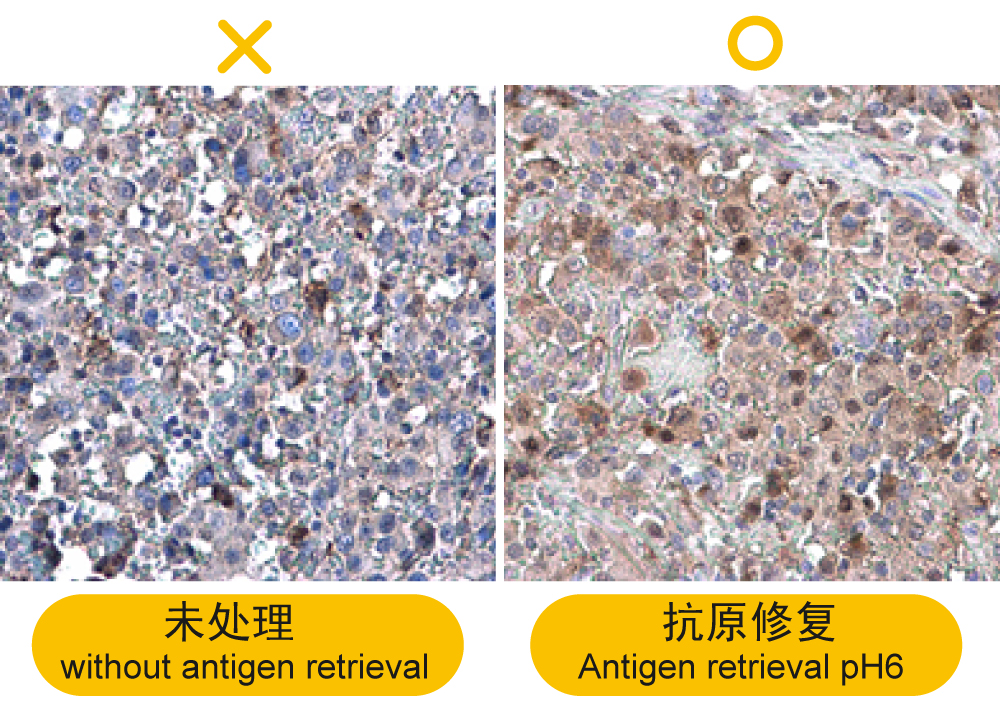
b.使用冰冻切片样本:冰冻切片一般不做抗原修复,因为抗原修复方式对冰冻切片可能太过强烈,也不需脱蜡、覆水或操作切片后固定等步骤,能够较完好地保存细胞膜表面和细胞内多种酶活性以及抗原的免疫活性。 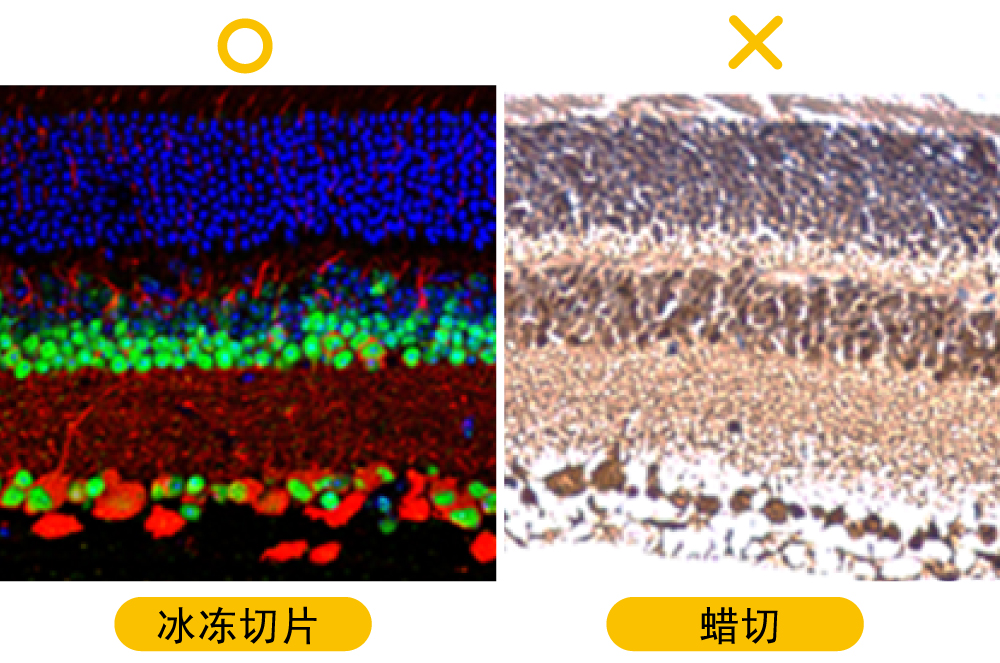

解决方案: a.防止组织中冰晶形成:
-速冻使组织温度骤降, 减少冰晶的形成。
-固定后将组织置于20%~30%蔗糖溶液1~3天, 利用高渗吸收组织中水分, 减少组织含水量, 可防止或减少冰晶的形成。
其他疑难解答
-
问题排除技巧下载
-
轻松拿取玻璃片的小技巧 (ICC/IF)
-
ICC问题排除-细胞染错位置, 原来搞错这事

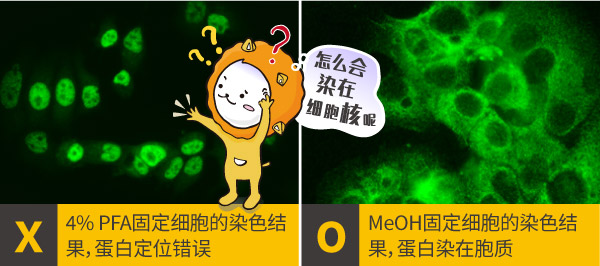
「文献说这目标蛋白应该染在细胞质, 怎么我就染在细胞核, 到底哪里出错呢?」相信这是许多人做细胞染色会遇到的问题, 染色不仅要染的漂亮, 还要染对, 没有些技巧可是很容易失败的。
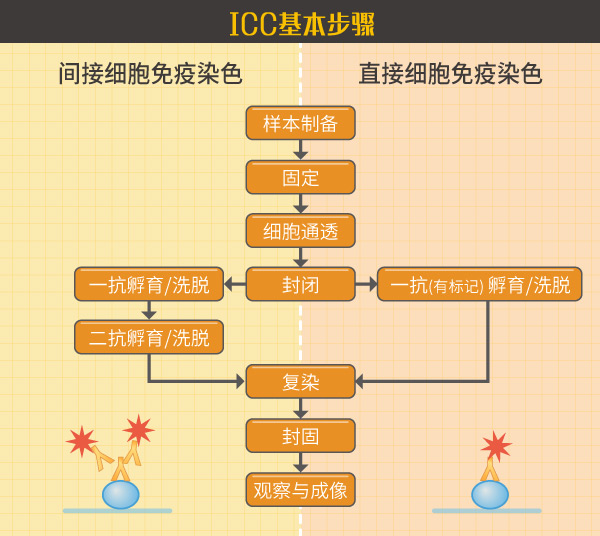
免疫细胞化学(Immunocytochemistry,ICC)为常用的实验方法,主要样品为细胞,因常使用荧光标记所以在应用上常常写成ICC/ IF。相对的,免疫组织化学(IHC)样品为组织,可使用荧光或化学方式呈色。细胞免疫染色步骤如上图,需将细胞固定在盖玻片上经过通透、一二抗染色等步骤, 最后成像拍照。当ICC染色定位不正确怎么办呢?莫急莫荒莫害怕 1. 可检查细胞爬片与2. 检查固定与通透。
ICC型态不佳/信号定位不正确怎么办呢? 检查这2件事,一切都搞定!

重点1: 细胞黏附好,型态才会好
a.盖玻片处理: 通常细胞在盖玻片上黏附能力都不强,可以使用几种成分铺在盖玻片上,以增强细胞与玻璃盖玻片的黏附,常用的溶液成分如下表,不同的细胞需进行个别的调整,以得到最佳的结果。
一般药品 细胞外基质蛋白 Poly-lysine (0.05-0.1 mg/ml) Laminin (0.05-0.1 mg/ml) Poly-ornithine (0.1 mg/ml) Fibronectin (0.05-0.1 mg/ml) HCl (0.1-1 M) Gelatin (0.1%)
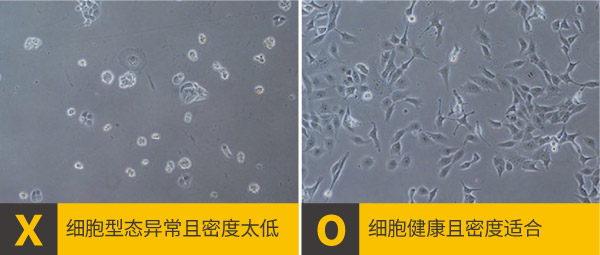
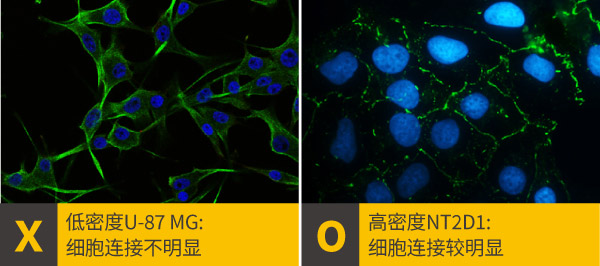
Collagen (0.05-0.1 mg/ml)b.细胞状态和细胞密度: 细胞的健康状态、型态与密度,可能会影响靶标蛋白的表达与定位,一般使用分盘后培养隔夜(时间太短细胞贴附不完全,太长细胞会太老不健康),细胞密度约50-70 %的爬片,密度太高或太低都可能对靶标蛋白的定位产生负面的影响,需要根据靶标特性调整适宜的细胞类型与密度,例如在研究细胞连接标记蛋白时,维持细胞与细胞间的接触就特别重要,选择较容易观察到细胞连接的细胞种类,最佳细胞密度也要有80%以上。
N-Cadherin antibody (GTX112734)
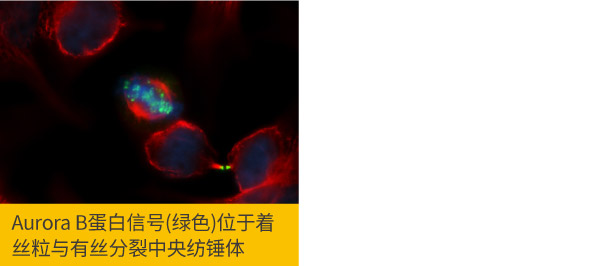
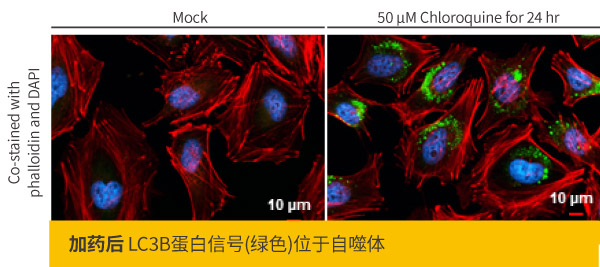
c.细胞培养条件: 有些靶标蛋白的表达和定位,随着细胞周期或细胞应激反应而变化,须确保用来制作爬片的细胞状态为观察靶标蛋白的最佳条件,例如观察细胞分裂相关蛋白,可将细胞做同步处理,使细胞处于同一个细胞周期阶段,否则就需要在细胞爬片中仔细观察靶标蛋白的信号,又如观察自噬反应中的LC3B蛋白,如未加入诱发细胞展开自噬的药物,将较难观察到正确的定位结果。
Aurora B antibody (GTX132702)
LC3B antibody (GTX127375)
重点2: 悬浮细胞染色有诀窍
a.分盘时,将细胞悬浮溶液接种于涂层处理过的盖玻片上,接着即可比照黏附型细胞的实验步骤。
RIP3 antibody (GTX131188)
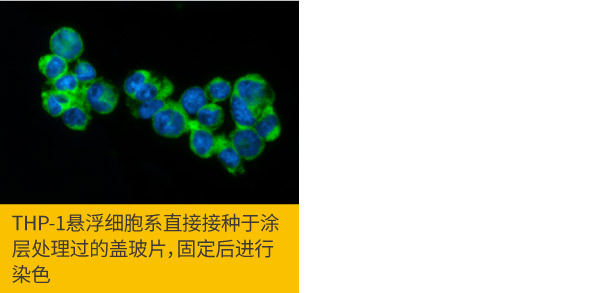
b.在细胞悬浮溶液中进行完固定步骤,利用细胞离心技术(CytospinTM)将细胞低速离心至涂层处理过的盖玻片上,也可以用移液管吸取细胞悬浮液滴于已涂层的盖玻片上。
c.在悬浮状态中进行完所有染色步骤,最后用移液管移至器皿或载玻片上进行显微镜成像。
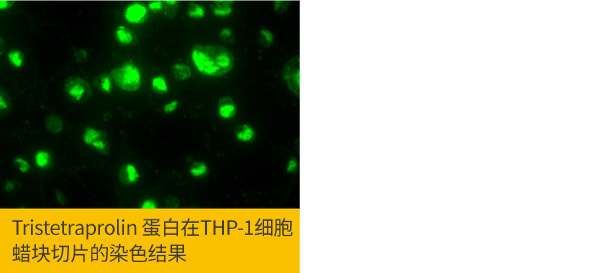
d.小星狮小技巧: 可以将固定后的悬浮细胞溶液与2-3 % 的琼脂等比例混合,将细胞检体包覆,待琼脂胶体凝固后,再按照常规的脱水、包埋程序做石蜡包埋,制作成的细胞蜡块,之后再进行组织切片,此玻片样本可照一般石蜡组织切片IHC的操作方法进行免疫化学染色,与一般ICC最大的不同为: 此组织蜡块制作的玻片需烤过,再进行脱蜡与回水,也需要进行抗原修复的步骤,基本上是当作IHC进行实验,对于较难得到的细胞样本(如病毒感染的细胞),可用此方法保存细胞蜡块,日后若有需要只要进行切片即有样本。
Tristetraprolin antibody (GTX130974)
Dengue virus NS1 protein antibody (GTX124280)
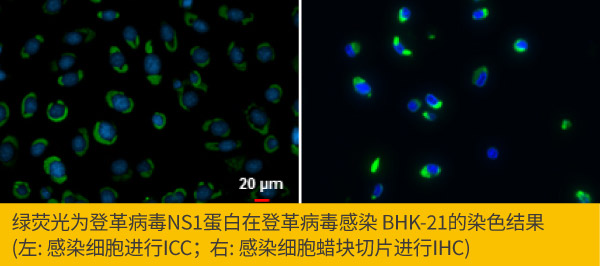

样品的固定与通透对实验结果影响很大,最适合的固定与通透方法,与细胞类型、靶标蛋白和使用的抗体有关,尝试不同的固定和通透条件,将有助于得到靶标蛋白在抗体染色的最佳信号与正确定位。
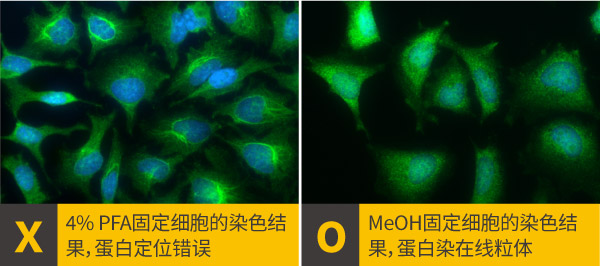
a.固定剂的选择: 固定剂主要有两大类,交联剂(如多聚甲醛)与有机溶剂(如甲醇或丙酮),交联剂通过疏水性交联把蛋白与蛋白连起来,有机溶剂能使细胞脱水,把蛋白质沉淀在细胞结构上,也具有细胞通透的性能,多聚甲醛、甲醇和丙酮等都是很常用的固定剂,建议最初从4% PFA,固定15分钟开始尝试,倘若没有达到预期效果,再调整固定时间或更换另一种固定剂,GeneTex在固定剂的使用经验整理如下表,但仍须根据靶标蛋白或抗体的不同逐步调整出最佳方案。
靶标蛋白类型 较适合固定剂 细胞膜 交联剂 细胞质 交联剂/有机溶剂 细胞骨架 有机溶剂/交联剂 高尔基体 交联剂/有机溶剂 细胞核 交联剂 细胞核膜 有机溶剂/交联剂 细胞核仁 有机溶剂 内质网 交联剂 中心体 有机溶剂 纺锤体 有机溶剂/交联剂 溶酶体 有机溶剂/交联剂 线粒体 有机溶剂 自噬体 有机溶剂 翻译后修饰化靶标蛋白(PTM) 交联剂 mTOR antibody [C3], C-term (GTX101557)
MUL1 antibody (GTX112673)
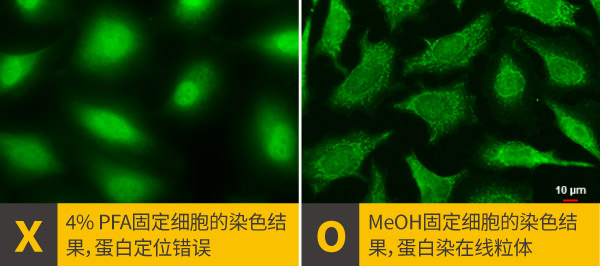
LAMP3 antibody (GTX112715)
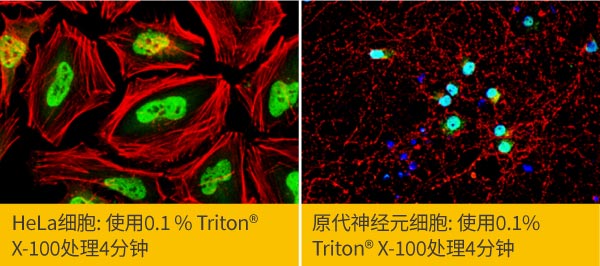
b.通透条件的选择: 由于抗体无法直接穿过数十微米的细胞质膜进入细胞,因此,检测胞内的靶标蛋白时,需进行通透化处理,利用除垢剂在细胞膜形成孔洞,使得抗体得以进入细胞内,常用的除垢剂有Triton® X-100, NP-40, Tween 20或皂甘等,建议从0.1 % Triton® X-100,通透5分钟开始尝试,倘若没有达到预期效果,再调整通透时间或通透剂浓度,也可以考虑更换另一种通透剂,有机溶剂固定剂会引发细胞变性脱水,因此也会破坏细胞膜的完整性,较不适合细胞膜靶标蛋白染色,一般来说,有机溶剂固定之后也不建议进行细胞通透的步骤,最佳的细胞通透方法,一样需要根据靶标蛋白与所使用的抗体而调整,无法用一种方法套用到所有的实验。
CD45 antibody (GTX116018)
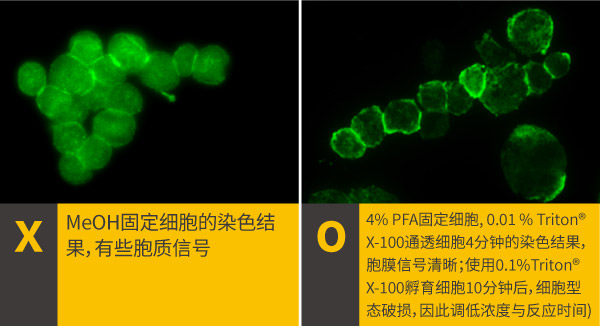
TDP43 antibody (GTX114210)