FAQs
购买 FAQ
-
购买 FAQ
Q1: 如果我对产品有疑问,可以联系谁?为了满足您的需求,请在购买前联系 sales@genetex.com或当地经销商以获取更多信息,我们将帮助您选择最佳产品进行实验。
常见问题
-
GeneTex抗体的五大策略验证

GeneTex深知值得信赖的抗体是加速实验进行与实验具有再现性唯一且必须的工具,因此GeneTex使用各种验证方式来确认我们的抗体品质, 解决批次再现性与专一性问题,并依据2016年Nature Methods上发表的抗体特异性验证指南,将此五大策略纳入生产验证流程……
2016 年 Nature 子刊建议的 5 种抗体验证方式,即是挑选抗体的金标准。
五大验证包含基因敲除敲弱验证、比较抗体验证、免疫捕获与质谱分析、生物特性与正交策略、蛋白过表达策略等验证方式,说明如下:
一、基因敲除敲弱验证

利用CRISPR/Cas9或RNAi等技术,将目标基因敲除或敲弱以验证抗体对蛋白质表现量变化的信号反馈。
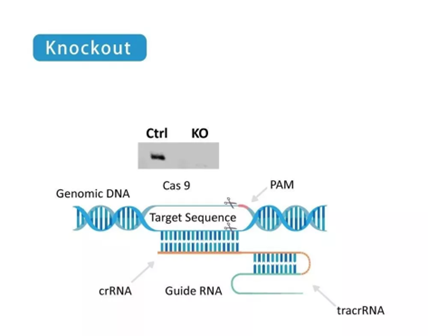
敲除(Knockout)使用 CRISPR/Cas9 将目标基因从整个基因组去除,使目标蛋白不表达,收取此 Knockout 细胞裂解液作为对照组,可确认抗体专一性。
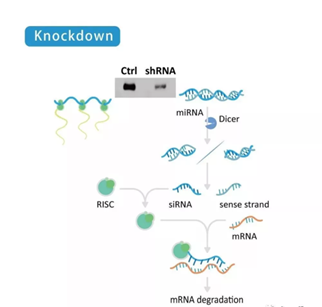
敲弱(Knockdown)使用 siRNA 将目标基因静默,基因还在,但蛋白表达量降低甚至不表达。收取此 Knockdown 细胞裂解液作为对照组,可确认抗体专一性。
基因敲除敲弱验证就是取有表达蛋白的细胞裂解液,跟使用基因技术去除或减少蛋白的裂解液做比较,如果抗体专一性辨识蛋白,应该会出现一个样本有强条带,另一个样本弱(无)条带,如抗体无专一性则条带无变化。
范例: 白血病标记物-CD44癌症抗体 (GTX628895)
CD44参与介导细胞存活的迁移、增殖、分化和信号传导途径。GTX628895抗体是小鼠单克隆抗体,使用基因敲除的细胞裂解液进行验证,可看到处理后条带消失,证实抗体特异性辨识 CD44 蛋白,适用多种应用,包括 WB、IHC-P、FACS 和 IP,且被多篇文献引用,为可靠的抗体工具。
![CD44 antibody [GT462] (GTX628895) CD44 antibody [GT462] (GTX628895)](/upload/media/MarketingMaterial/Newsletter/2022/CN/5P/PIC03_640.jpg)
CD44 antibody [GT462] (GTX628895) 



二、比较抗体验证

使用两种可识别目标蛋白表面不同抗原表位的独立抗体,并通过对比或定量分析确定特异性。相同靶标、相同处理的样品,理论上抗体辨识的条带位置应该相同。如不相同,可能有其一抗体辨识错误蛋白或是其他原因;另外也可以通过比较找到更高敏的抗体。
范例: 乳癌标记物-人表皮生长因子受体-2(HER2,也称 Neu 或 ERBB2)(GTX100509)
临床上 Her2 的检测多采用免疫组织化学法检测其表达水平,也是决定能否使用靶标治疗的依据之一。GTX100509 HER2/ERBB2 抗体使用两个不同的抗体进行比较(如下),确认有一致性的染色图谱,而 GTX100509(左)灵敏度甚至比其他厂家来的更高。
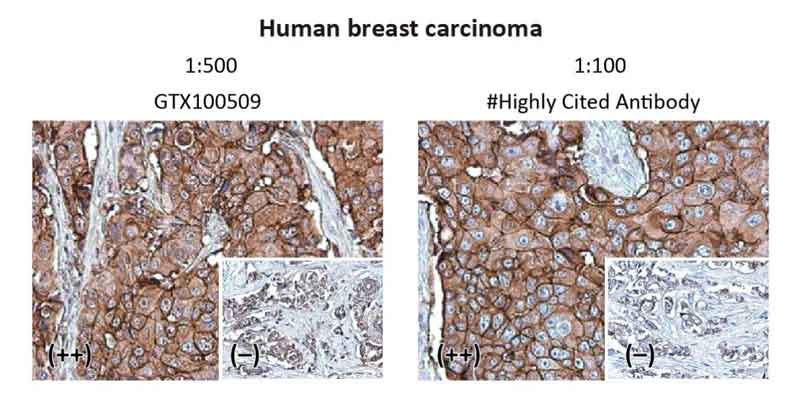
Her2 / ErbB2 antibody (GTX100509) 



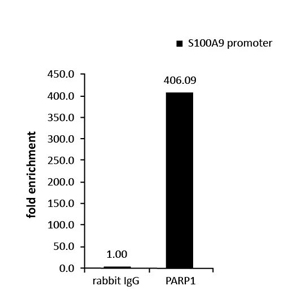
三、免疫捕获及质谱分析

利用IP/MS分析可直接捕获与抗体直接发生相互作用的目标蛋白以及其所形成的蛋白质复合物,将免疫捕获的目标蛋白进行质谱分析,可确认捕获的蛋白身份是否为目标蛋白,以此确认抗体是否辨识到对的蛋白。
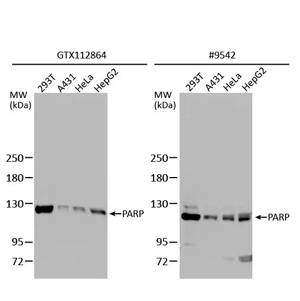
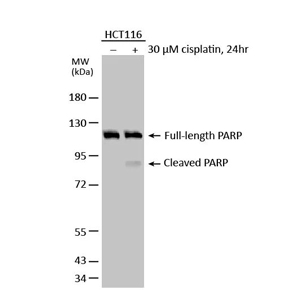
范例:DNA 修复、基因稳定性及细胞凋亡研究常会使用的 PARP 抗体 (GTX112864)
GTX112864 PARP 抗体通过免疫捕获及质谱分析验证(PMID:30377371),可进行 WB、ICC/IF、IHC-P、IP、ChIP assay 等多种应用,GeneTex的“PARP antibody [N2C1], Internal”通过了五项“抗体验证支柱”的所有测试,证实其具高质量,高性价比,与高特异性的产品优势。此外,它已在多篇文献中被引用,在不同物种上均能进行DNA修复,基因组稳定性和细胞凋亡方面的研究。
比较抗体验证 
生物特性与正交策略 
基因敲除敲弱验证 
免疫捕获及质谱分析 
目标蛋白过表达 
PARP antibody [N2C1], Internal (GTX112864)






四、生物特性与正交策略

生物特性与正交策略是指利用目标蛋白质本身的生物特性作为基础进行定性与定量验证,或使用非抗体依赖方法(例如RNA表达量),检测基于抗体与生物特性或非抗体定量间的相关性,来验证抗体的专一性,包含:
- 使用加药测试;
- 以特殊条件处理细胞;
- 使用已知具有蛋白高低表达量的样本作为阳性与阴性对照组;
- 细胞定位;
- 组织专一性。
范例: 胰脏癌标记物 KRAS (GTX635362)
当 KRAS 基因突变,细胞分裂将不受控制,形成肿瘤。其中 KRAS G12D 和 G12V 突变占这些变化的 75% 成为研究的热点。在市面上有许多 KRAS G12D 的抗体,选择抗体时可优先挑选经过验证的,如有组织染色的结果更佳,像是GeneTex 的兔重组单抗 GTX635362。GTX635362 RAS(G12D 突变体)抗体通过使用多种细胞及正常与癌组织对照进行正交策略验证;在人胰腺癌细胞系和 PDAC 小鼠模型的 RAS G12D 突变蛋白表现出高度的敏感性和特异性。右图为蛋白印迹(WB)和左图为免疫组化(IHC-P)。
![RAS (G12D Mutant) antibody [HL10] (GTX635362) RAS (G12D Mutant) antibody [HL10] (GTX635362)](/upload/media/MarketingMaterial/Newsletter/2022/CN/5P/PIC10_640.jpg)
RAS (G12D Mutant) antibody [HL10] (GTX635362) 

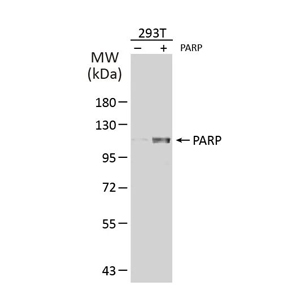
五、目标蛋白过表达

利用在细胞中过表达目标蛋白,并收取细胞裂解液后进行 WB 分析,理论上蛋白量增多,抗体辨识后的信号也会增强,因此可确认抗体是否特异性辨认正确蛋白,过表达目标蛋白可作为抗体验证的正控制组。
范例: 表观遗传学重要蛋白 TET1抗体 (GTX124207)
TET1蛋白一般在细胞内的表达量较低, 蛋白生命周期也短, 往往不易检测。这时可进一步使用过表达 TET1 的细胞裂解液作对照(下图 B),可看到抗体辨识的条带会明显增强,确定抗体辨识具有特异性。
![TET1 antibody [N3C1] (GTX124207) TET1 antibody [N3C1] (GTX124207)](/upload/media/MarketingMaterial/Newsletter/2022/CN/5P/PIC_11_640.jpg)
TET1 antibody [N3C1] (GTX124207) 



五项验证要同时通过吗?
五项验证要同时通过是非常困难的,主要受限于技术与材料,大部分的抗体验证仅能通过 1~2 项的验证,能同时通过 5 项验证可说是少之又少,GeneTex的GTX107678 NFkB p65抗体就是少数的例子之一,该抗体通过 5 项验证方法,并且全面验证 WB、ICC/IF、IHC-P、IP、EMSA,是目前唯一一个能同时通过 5 种验证的 NFkB p65 抗体。
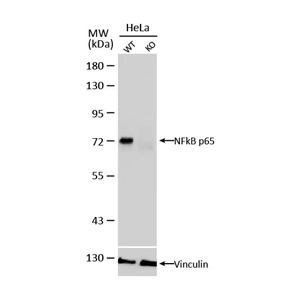
基因敲除敲弱验证 
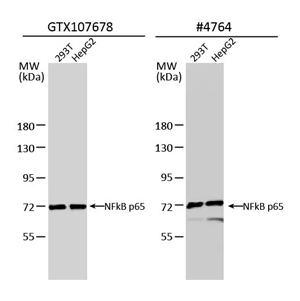
比较抗体验证 
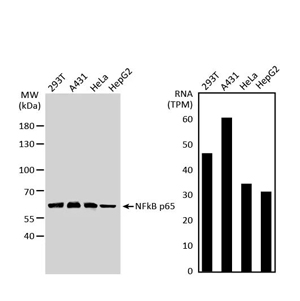
生物特性与正交策略 
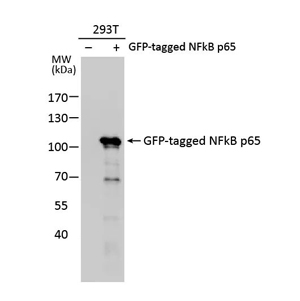
目标蛋白过表达 
注:【免疫捕获及质谱分析】验证数据请参考 Nat Methods 期刊(PMID:30377371)
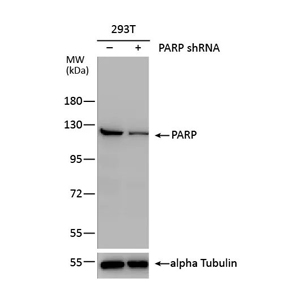
GeneTex还有 GTX628887 EGFR 抗体和GTX112864、GTX112839 PARP 抗体抗体都是少数同时通过五种验证的例子。
![EGFR antibody [GT133] (GTX628887) EGFR antibody [GT133] (GTX628887)](/upload/media/MarketingMaterial/Newsletter/2022/CN/5P/PIC_16_640.jpg)
EGFR antibody [GT133] (GTX628887) 





-
抗体挑选

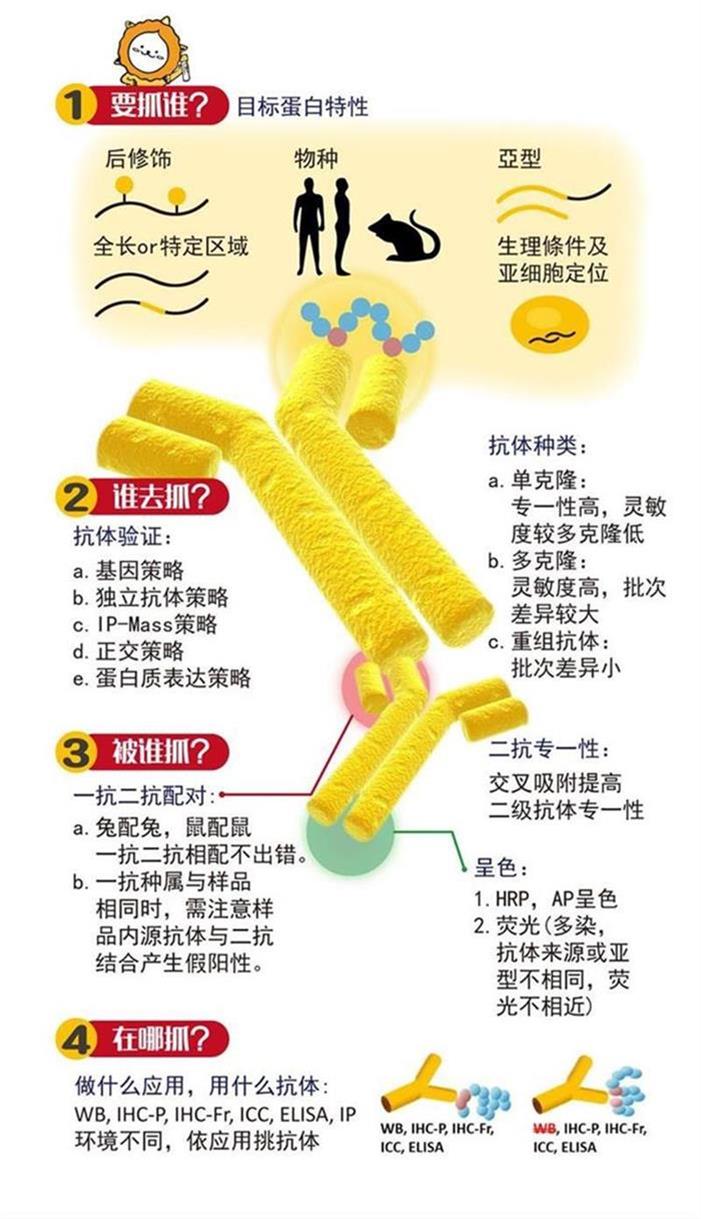
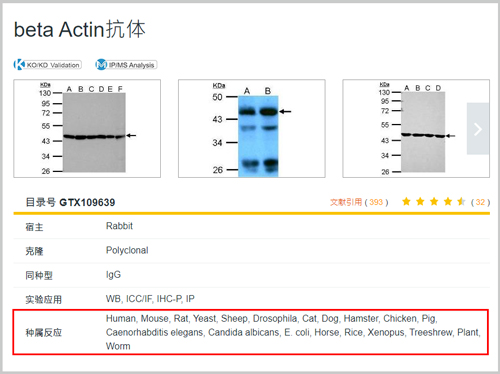
1.要抓谁?目标蛋白特性 挑选抗体时要先了解目标蛋白特性,才能挑选到适当的抗体。蛋白的特性可从物种、修饰化、亚型、抗原区段、生理环境五个方面进行确认。 ∎物种: 许多蛋白具有物種同源性,因此抗体可和不同物种的同源蛋白结合,例如大部分物种的actin序列相近,抗体可以跨物种进行辨识。但并非每种蛋白跨物种时抗体仍能辨识;因此,使用抗体前需先确认抗体可辨识的物种,如物种较特殊,也可联络厂家进行序列比对。部分产品序列可能为商业机密,此时可提供研究的序列给厂家进行确认。 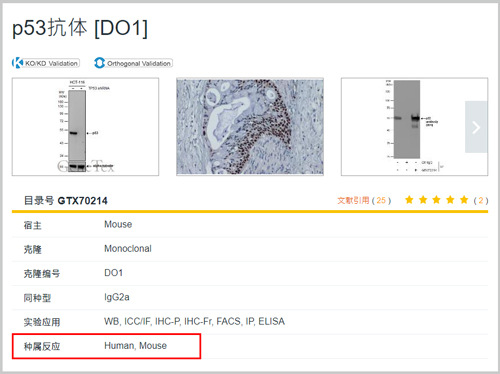
▲说明:抗体辨识蛋白质直线型序列 (连续序列) 适用WB, IHC-P, IHC-Fr, ICC, ELISA, IP ∎后修饰: 蛋白具有许多修饰化,如磷酸化、甲基化、糖化等,不同的修饰化,会使WB跑胶时条带的位置与预期分子量不同,挑选抗体时可先了解蛋白修饰化对分子量的影响,减少误判。 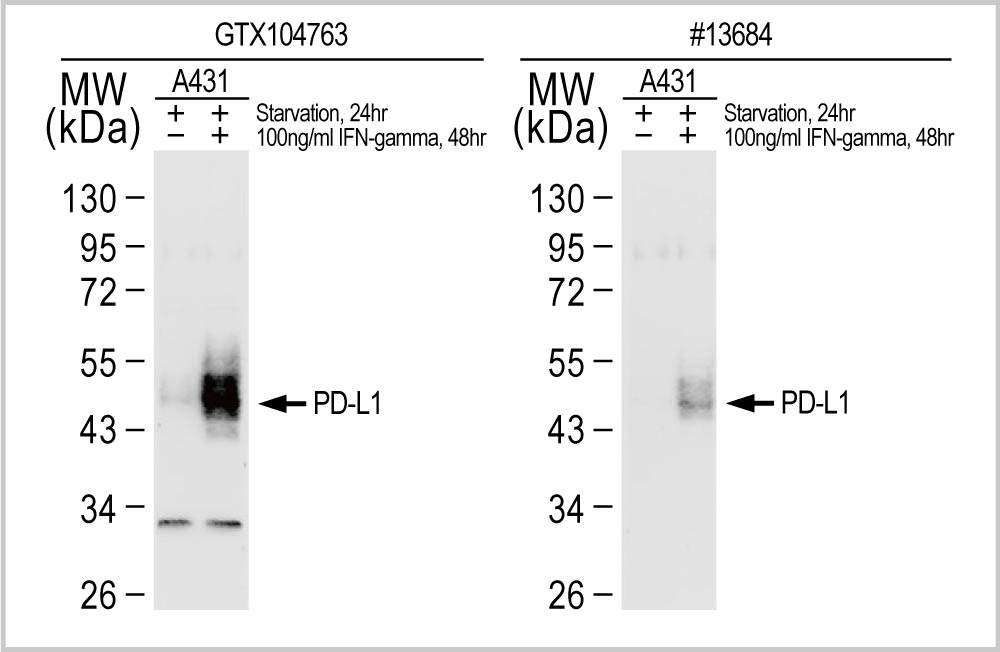
∎亚型: 许多蛋白具有亚型,不同亚型功能可能不同。因此挑选抗体时需确认研究的蛋白是否有亚型,研究主题是否需对特定亚型进行辨识?如有特定亚型的需求时,可查看产品说明书,确认抗体辨识的是保守序列(conserved sequences)还是只针对特定亚型进行辨识。 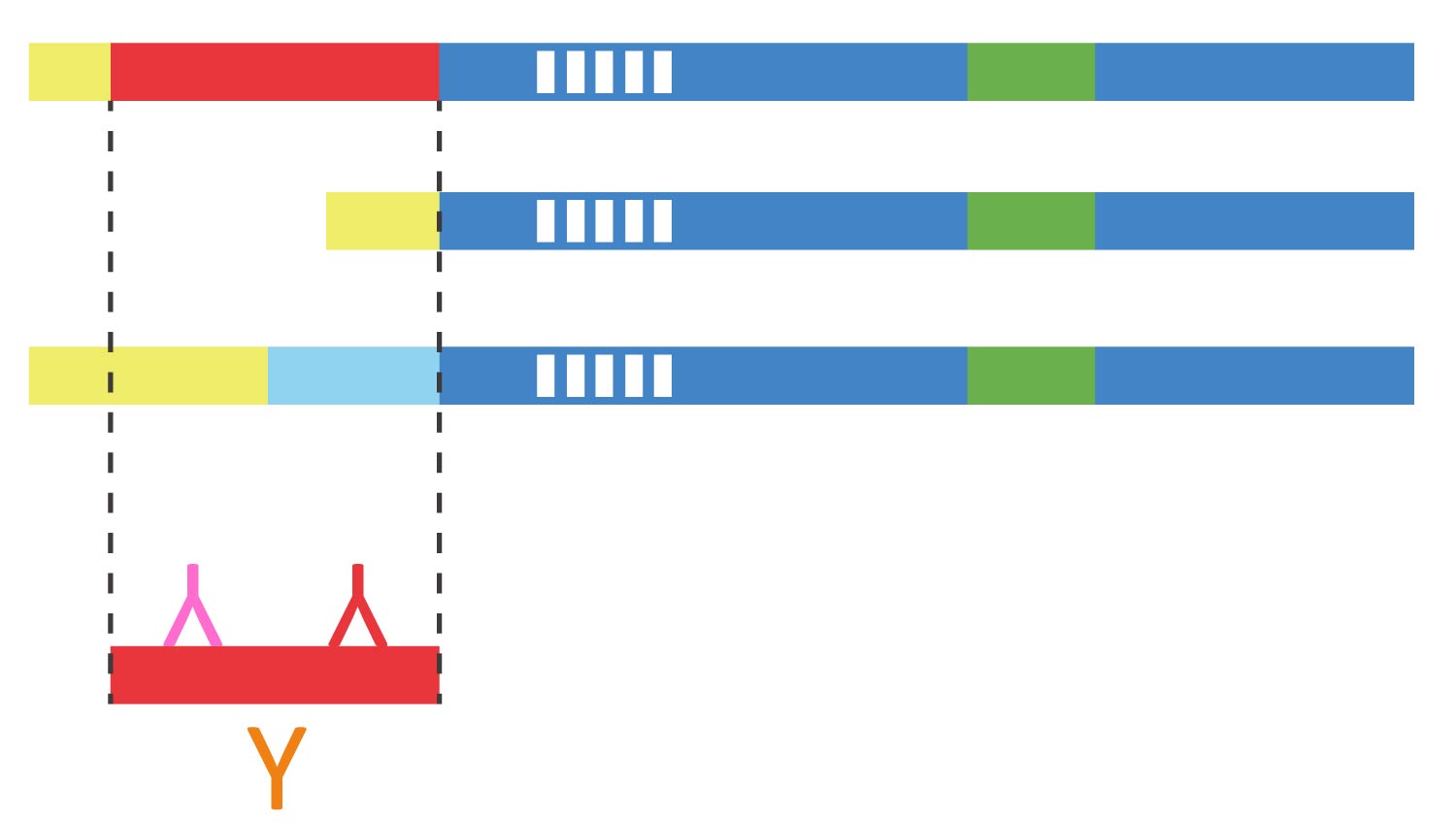
▲说明:抗体辨识蛋白质直线型序列 (连续序列) 适用WB, IHC-P, IHC-Fr, ICC, ELISA, IP 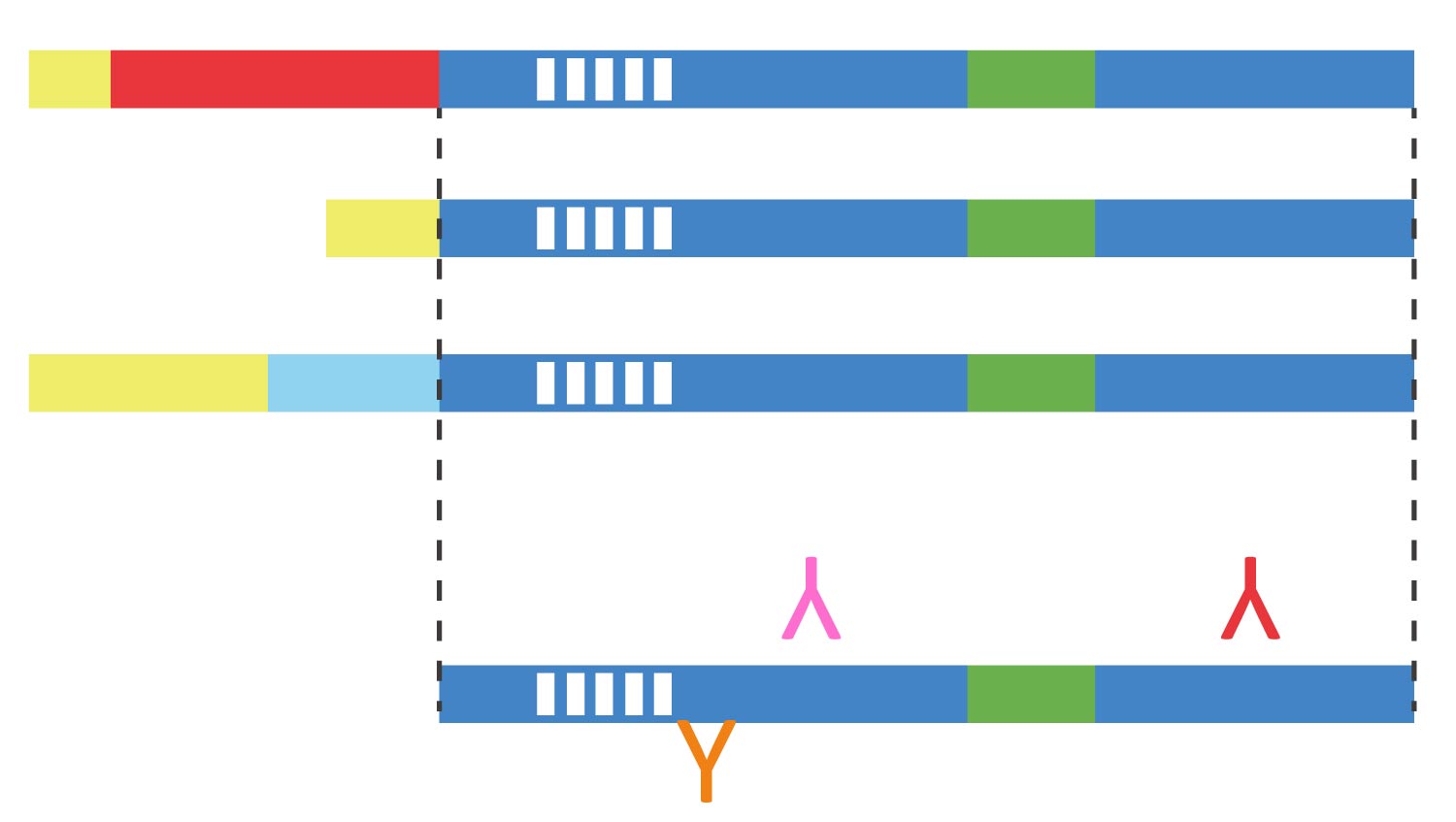
▲说明:抗体辨识蛋白质直线型序列 (连续序列) 适用WB, IHC-P, IHC-Fr, ICC, ELISA, IP 
▲说明:抗体说明书可查找抗体辨识的抗原区段(GTX104763, PD-L1 antibody)。 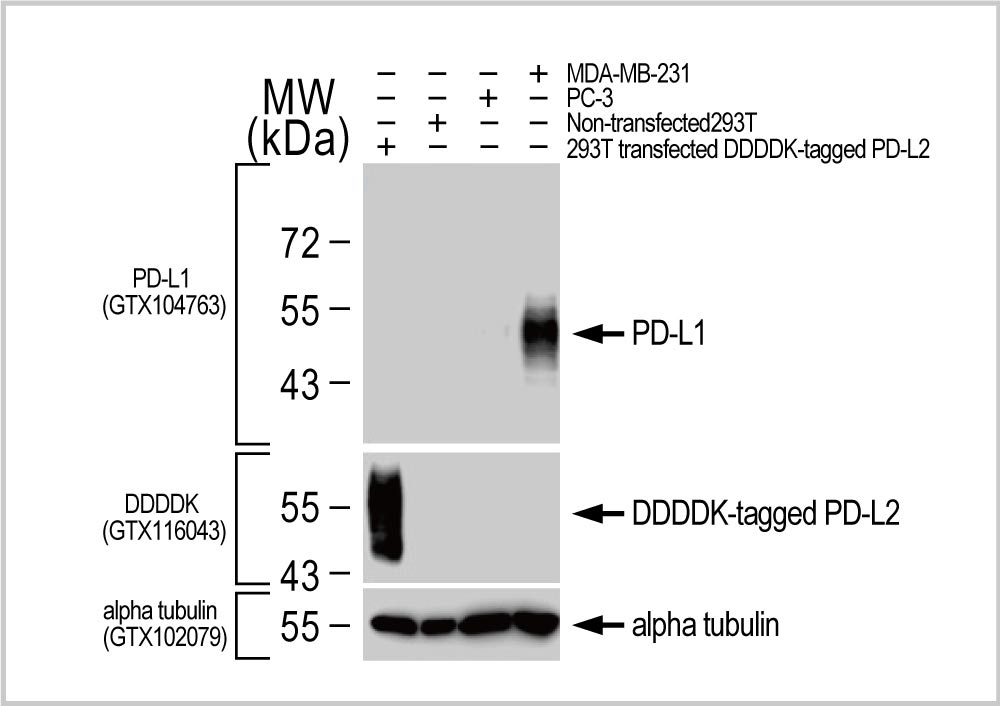
GTX104763 PD-L1 antibody ▲说明:只辨识PD-L1,不会认到PD-L2 另外,如研究主题为切割后的活性蛋白,也可查看抗体是否是辨识活化后的蛋白。 ∎生理环境: 有些蛋白需在特定生理条件才会表达,如发炎、自噬等,或是仅在特定细胞器,甚至特定细胞或组织才可观察到;因此,挑选抗体时,应先确认蛋白表达的时机及细胞组织的分布,掌握这些信息, 再查看抗体是否有对应的验证, 有助于挑选正确的抗体 。 2.谁去抓?一抗特性 确认目标蛋白信息后,接着可从验证方式与纯化方式来了解抗体的质量。 ∎GeneTex 5大抗体验证: 
使用CRISPR/Cas9或RNAi等技术,将目标基因敲除或敲弱以验证蛋白质表达量产生变化时, 抗体对应的信号反馈。 
使用2种(或以上)可识别目标蛋白不同抗原决定簇的独立抗体,通过对比或定量分析确定特异性。 
以生物特性作为基础, 进行定性与定量验证,甚至使用非抗体依赖方法(例如RNA表达量)来检测抗体与生物特性或非抗体定量间的相关性。 
为确认抗体侦测的信号为目标蛋白, 使用过表达目标蛋白作为抗体验证的正控制组。 
使用IP-MS分析,可定义与抗体发生交互作用的目标蛋白为何,以及其所形成的蛋白质复合物。 ∎抗体种类: ⓐ单克隆:专一性高, 灵敏度较多克隆低
ⓑ多克隆:灵敏度高, 批次差异较大
ⓒ重组单株抗体:批次差异小
∎抗体纯化方式: -未纯化 ❶血清:未经纯化的血清, 含有识别抗原的抗体,也有其他非专一的抗体,成分较复杂, 以血清进行实验一般较容易有杂讯,在说明书纯化方式标示为”Serum”。此形态常出现在多克隆抗体。 例如:GTX11136 GAP43 antibody ❷细胞上清液:单克隆抗体的杂交瘤经细胞培养后,会释放抗体在培养液中,收取此培养上清液可获得抗体,在说明书纯化方式标示为”Culture Supernatant或Cell Supernatant”。此形态常出现在单克隆抗体。 例如:GTX78213 GAPDH antibody [1D4]即为上清液形式的抗体。 ❸腹水:单克隆抗体的杂交瘤打入小鼠的腹腔(或与杂交瘤相同的物种)后会产生腹水,此腹水含有高浓度的抗体,在说明书纯化方式标示为”Ascites”。此形态常出现在单克隆抗体。 例如:GTX11178 S100 beta antibody [SH-B1] -纯化(血清细胞、上清液、腹水可进一步通过纯化,增加抗体的纯度,一般常见的方式有ProteinA/G和亲和层析) ❶Protein A/G:金黄色葡萄球菌蛋白A跟链球菌蛋白G与免疫其蛋白的Fc区域有高度亲和性,可去除其他蛋白,纯化出免疫球蛋白。在说明书纯化方式标示为”Protein A /G purified” 例如:GTX627420 TET1 antibody [GT1462] ❷亲和层析:抗原亲和层析纯化方式是利用抗原来纯化抗体,可过滤非特异性的抗体与其他蛋白,得到特异性的抗体。纯化方式在说明书标示为”Purified by antigen-affinity chromatography”。例如:GTX112864 PARP antibody [N2C1], Internal 3.被谁抓?二抗特性 二抗可与一抗结合,其后接有酶标或荧光素呈色,可用来放大讯号。二抗挑选要注意与一抗配对,呈色和交叉反应。 ∎二抗与一抗配对: 二抗选择最重要的原则,兔配兔,鼠配鼠,isotype相配不出错。例如你的一抗物种是小鼠IgG1亚型,那么二抗就选抗IgG1的二抗。如果只知道物种,但不知道亚型,也可选不分亚型的IgG。另外,在实际操作时,有时会遇到一抗种属与样品相同,这时需额外注意样品是否含有内源抗体与二抗结合产生假阳性。 物种 Clonality 小鼠 IgA, IgD, IgE, IgG(IgG1、IgG2a、IgG2b、IgG2c和IgG3) and IgM 兔 IgA(IgA1, IgA2, IgA3, IgA4, IgA5, IgA6, IgA7, IgA8, IgA9, IgA10, IgA11, IgA12, IgA13, IgA14), IgE, IgG, and IgM 山羊 IgA, IgE, IgG1, IgG2, IgE, IgM 大鼠 IgA, IgD, IgE, IgG(IgG1、IgG2a、IgG2b和IgG2c)and IgM 鸡 IgY 人 IgA, IgD, IgE, IgG(IgG1, IgG2, IgG3, IgG4), and IgM ∎呈色怎么选: 市面上呈色方式有很多选择,但主要可归为两类 1.酶呈色:如HRP辣根过氧化酶和AP碱性磷酸酶。western blot,组织免疫化学和ELISA常用酶标二抗。 2.荧光染色(FITC, RRX, TR, PE)(如遇多染, 抗体选择来源或亚型不相同,荧光不相近) 细胞免疫化学,组织免疫化学,流式细胞实验通常使用荧光基团标记的二抗。如果样品是低表达量,想要更大程度的放大检测信号,可以使用biotin/avidin检测系统。 ∎二抗专一性: 我的二抗认mouse IgG, 也会认到rabbit IgG吗? GeneTex推出交叉吸附型二抗,提高二抗专一性,通过不同物种抗体的固定基质管柱,过滤非专一性的二抗,减少二级抗体产生来自非目标抗体的交叉反应 (cross-reactivity),有效增加其二抗的专一性。例如:GTX35185 Mouse IgG1 antibody, pre-adsorbed (HRP) 4.在哪抓?哪种应用 ∎做什么应用, 用什么抗体: WB, IHC-P, IHC-Fr, ICC, ELISA, IP实验环境不同,目标蛋白的折叠方式也不同,抗体与目标蛋白的结合能力也不一样,一个抗体不一定能适用于各种应用,有些抗体无法结合变性的蛋白(如下图),这会在western blot出现糟糕的结果。因此挑选抗体时, 可先参考厂家的说明书,再通过网站的筛选功能快速找到需要的抗体。 
▲说明:抗体辨识蛋白质直线型序列 (连续序列) 适用WB, IHC-P, IHC-Fr, ICC, ELISA, IP 
▲说明:抗体辨识蛋白质结构型序列 (不连续序列) 适用IHC-P, IHC-Fr, ICC, ELISA, IP(做WB时,结构打开,无法结合变性蛋白) 掌握以上挑抗体四個要诀,我们与对的抗体零距离! 

-
我应该在什么温度下储存我的抗体或试剂?
有关具体建议,请参阅每个产品的说明书。通常,抗体可在4 ºC冷藏短期(1-2周)储存,如果存放时间较长,请将抗体分装,并保存在-20ºC或更低温的无霜冰箱中,避免反复冻融;如果储存不当,可能会影响产品的效能。
-
分装抗体时,每份应该放入多少体积?
可根据实验的要求调节分装试样的体积,但是,由于小体积更容易受到外部温度的影响,我们建议分装试样要> 10 ul。
-
GeneTex是否提供常见抗体应用的实验方法?
GeneTex在网站上提供常见应用的实验方法,尽管每个实验室都已经有自己的步骤,但仍然需要对每种抗体/试剂进行优化,请点击此处 click here 查看常规实验方法。
-
我可以重复使用稀释的抗体溶液吗?
GeneTex 无法保证稀释的抗体在重复使用时能够始终如一地发挥作用,这必须由研究人员凭经验进行测试。
-
我可以将抗体使用于说明书里未标明的物种或应用吗?
GeneTex 无法保证抗体适用于未说明的物种或应用,为确保抗体符合您的需求,请在购买前联系 sales@genetex.com以获取更多信息。