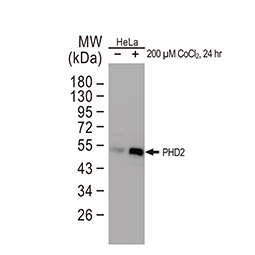
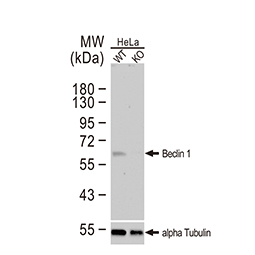
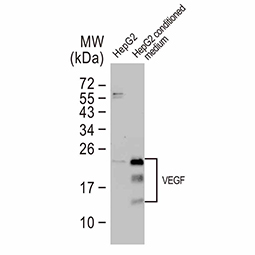
|
2019年诺贝尔生理学或医学奖揭晓-由William G. Kaelin Jr.、Sir Peter J. Ratcliffe 和 Gregg L. Semenza获得这一奖项,以表彰他们发现细胞如何利用分子机制感应与适应不同氧气浓度,为氧气浓度如何影响细胞生理建立基础,并启发了贫血、癌症与发炎等疾病治疗新契机而获得肯定。 Semenza最知名的成就是发现缺氧诱导因子(HIF-1α)。氧气感知与适应通路的核心为HIF-1蛋白,它能够启动动物细胞中多种对缺氧环境产生应激的基因,包括VEGF (血管内皮生长因子)、EPO (红血球生成素)等等,这些基因表达的蛋白能够刺激红血球生成、血管增生等生理过程,帮助生物体获得更多的氧气,他们也发现另一个蛋白VHL,可以随氧气浓度与HIF-1α作用,改变它的数量,进行调节(图一)。 |
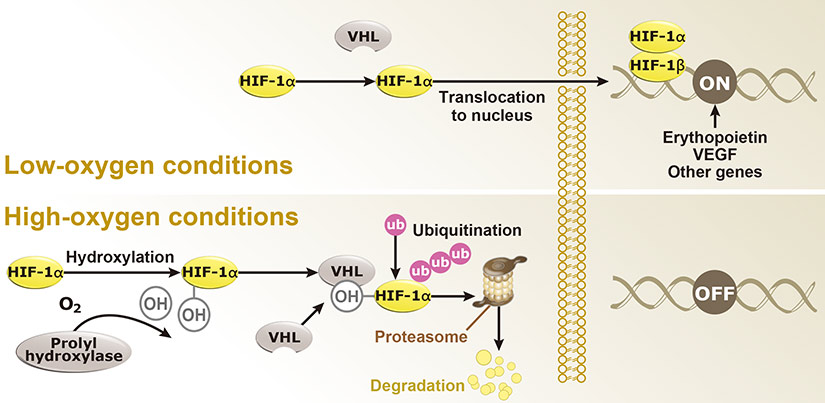 |
图一:氧气调节在低氧情况下(上),HIF-1α保持完整并进入细胞核与HIF-1β结合,从而启动基因表达,促进缺氧应激;相反的,在正常氧气水平时(下),prolyl hydroxylase利用分子氧 (O2)在HIF-1α上产生hydroxyl group (OH),于是VHL结合至HIF-1α,并标记ubiquitins,使得HIF-1α进行蛋白酶体降解,缺少HIF-1α,缺氧诱导基因即保持关闭。 |
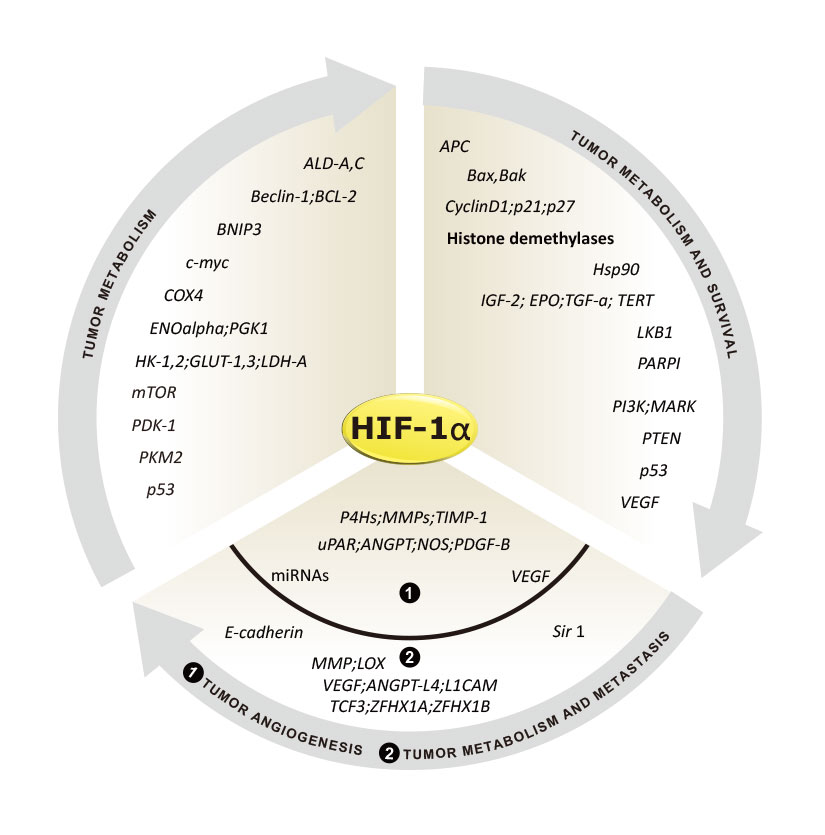 |
图二: HIF-1调节癌症相关基因在多种癌症中,由于癌细胞的迅速增殖,通常会造成在肿瘤附近的局部供氧不足,生物体的组织或细胞不能获取足够的氧,因此癌细胞常常会提高HIF-1α蛋白的表达,刺激生物体的血管增生,为肿瘤提供更多氧气和养分,能让癌细胞在低氧环境中生存,促进癌细胞的生长、侵袭、转移,使生物体产生发炎反应,并让癌细胞对于化疗、放疗极度不敏感。此外,不同基因突变也会造成HIF-1α的表达增加,包括致癌基因的功能获得性突变(ERBB2),以及抑癌基因的功能丧失性突变(例如VHL和PTEN)。HIF-1调控的基因(图二)与肿瘤的代谢、增殖、生存和转移,以及肿瘤血管增生息息相关,因此,抑制HIF-1蛋白和其相关蛋白(HIF-2α)的功能也成了抗癌药物研发的重要方向之一。 |
|
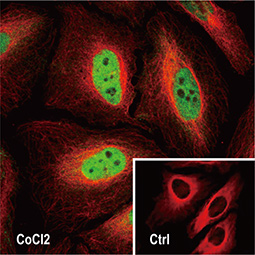
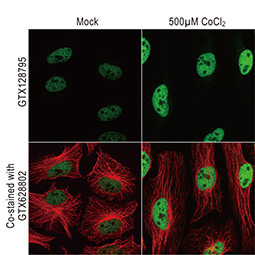
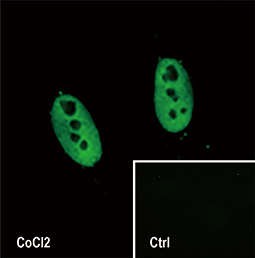
HIF-1α是缺氧反应(hypoxia)的关键蛋白,而缺氧反应不只影响癌细胞的生存也参与许多生理反应, 2012年起GeneTex致力开发缺氧研究相关抗体, 过程中使用多种验证策略,以确保抗体专一性与敏感性,在全球颇受好评。热门产品展示如下: |
| 热门指标 | |||||
|
|
|||||
|
|
|
|
|
|
|
|
|

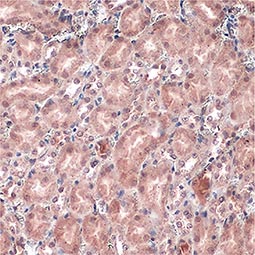
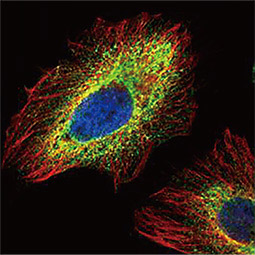
![Carbonic Anhydrase IX antibody [GT12] Carbonic Anhydrase IX antibody [GT12]](/upload/media/research/Cancer/Hypoxia/hypoxia_06.jpg)